
科目: 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
下列物质的转化在给定条件下不能实现的是( )
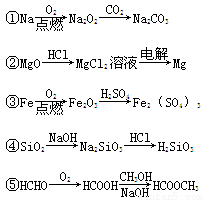
A.①②③ B.②③④ C.②③⑤ D.①④⑤
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:选择题
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是( )
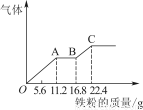
A.原混合酸中NO物质的量浓度为2 mol/L
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol/L
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
(1)写出铜与稀硝酸反应的化学方程式:________________________________________________________________________________________________________________________________________________。
(2)为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出溶出铜的离子方程式:________________________________________________________________________________________________________________________________________________。
(3)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S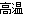 6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
6Cu+SO2↑,该反应的氧化剂是______________;当生成19.2 g Cu时,反应中转移的电子为__________mol。
(4)铜在潮湿的空气中能发生吸氧腐蚀而生锈,铜锈的主要成分为Cu2(OH)2CO3(碱式碳酸铜)。试写出上述过程中负极的电极反应式:________________________________________________________________________________________________________________________________________________。
(5)研究性学习小组用“间接碘量法”测定某试样CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。取a g试样配成100 mL溶液,每次取25.00 mL,滴加KI溶液后有白色碘化物沉淀生成。写出该反应的离子方程式:___________________________。继续滴加KI溶液至沉淀不再产生,溶液中的I2用硫代硫酸钠标准溶液滴定,发生反应的化学方程式为I2+2Na2S2O3=2NaI+Na2S4O6,平均消耗c mol/L的Na2S2O3溶液V mL。则试样中CuSO4·5H2O的质量分数为______________。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
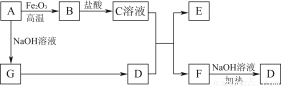
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”)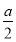 mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
合成氨工业生产中所用的α?Fe催化剂的主要成分是FeO、Fe2O3。
(1)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4∶5,其中Fe2+与Fe3+物质的量之比为________。
(2)当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为________(用小数表示,保留2位小数)。
(3)以Fe2O3为原料制备上述催化剂,可向其中加入适量碳粉,发生如下反应:2Fe2O3+C 4FeO+CO2↑。
4FeO+CO2↑。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题11金属元素单质及化合物练习卷(解析版) 题型:填空题
菱锌矿的主要成分是碳酸锌,还含有少量的Fe2O3、FeO、CuO等杂质。如图是以菱锌矿为原料制取轻质氧化锌的一种工艺流程,该流程还可以得到两种副产品——海绵铜和铁红。
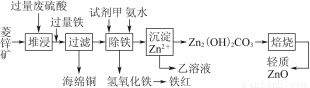
请结合下表数据,回答问题:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.3 | 9.7 |
Fe3+ | 1.5 | 3.2 |
Zn2+ | 6.2 | 8.0 |
(1)下列试剂中,________(填代号)可作为试剂甲的首选。
A.KMnO4 B.Cl2 C.H2O2 D.浓硝酸
根据所选试剂写出与之反应的离子方程式:________________________________________________________________________________________________________________________________________________。
(2)氢氧化铁固体会吸附一些SO42-,如何洗涤Fe(OH)3固体以及如何判断是否洗涤干净?
洗涤方法:______________________________________________________________,判断是否洗涤干净的方法是_______________________________________。
(3)除铁步骤中加入氨水的目的是调节溶液的pH,其适宜的pH范围是______________;调节溶液pH时,除了氨水外,还可以加入下列物质中的________。
a.Zn b.ZnO c.Zn(OH)2 d.CuO
(4)经测定乙溶液中仍含有少量的Fe3+和Zn2+。若c(Fe3+)为4.0×10-17 mol·L-1,则c(Zn2+)为______________ mol·L-1。(已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=1.2×10-17)。
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
下列对有机物结构或性质的描述,错误的是( )
A.将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应
B.苯分子中的6个碳原子之间的键完全相同,是一种介于单键和双键之间的独特的键
C.乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O
D.一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.氯乙烯的结构简式为CH2CHCl
B.蛋白质的水解产物为氨基酸,淀粉的水解产物为葡萄糖,均属于纯净物
C.乙烯与水在一定条件下发生加成反应,其产物是纯净物
D.含5个碳原子的有机物,每个分子中最多可形成4个碳碳单键
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
下列与有机物的结构、性质有关的叙述正确的是( )
A.聚氯乙烯、油脂均能使酸性KMnO4溶液褪色
B.石油的主要成分是烃,煤经过分馏可制得焦炭、煤焦油等产品
C.淀粉、纤维素的组成都可以用(C6H10O5)n表示,二者互为同分异构体
D.乙酸和乙醇可以发生酯化反应,又都可以与钠发生置换反应
查看答案和解析>>
科目: 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.溴乙烷和甲醇都能发生消去反应
B.乙烯和苯都能与酸性KMnO4溶液发生反应
C.糖类和蛋白质都是人体需要的营养物质
D.纤维素和油脂的水解产物都是葡萄糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com