
科目: 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:选择题
在A(g)+pB(g)=qC(g)的反应中,经t秒后C的浓度增加mmol·L-1,则B浓度的变化来表示的反应速率是 ( )
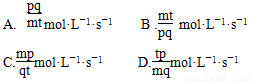
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:填空题
向某密闭容器中加入0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。
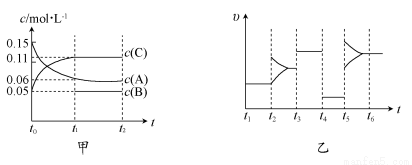
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为_____mol/L。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为akJ,写出该反应的热化学方程式_______。
(3)若t1=15s,则t0~t1阶段以C浓度变化表示的平均反应速率为v(C)=_______ mol/L,A的转化率为________。
(4)t3时改变的某一反应条件可能是________(选填序号)。
a.使用催化剂
b.增大压强
c.增大反应物浓度
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:填空题
甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l) HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
HCOOH(l)+CH3OH(l) ΔH>0,某小组通过实验研究该反应(反应过程中体积变化忽略不计)。反应体系中各组分的起始量如下表:
组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
物质的量/ mol | 1.00 | 1.99 | 0.01 | 0.52 |
甲酸甲酯转化率在温度T1下随反应时间(t)的变化见下图:
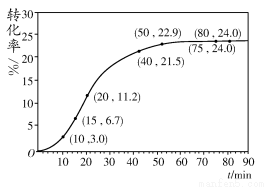
(1)根据上述条件,计算不同时间范围内甲酸甲酯的平均反应速率,结果见下表:
反应时间 范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
平均反应速率 /(10-3 mol·min-1 | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
请计算15~20 min范围内甲酸甲酯的减少量为________ mol,甲酸甲酯的平均反应速率为________ mol·min-1(不要求写出计算过程)。
(2)依据以上数据,写出该反应的反应速率在不同阶段的变化规律及其原因:
____________________________________________________________
(3)其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。

查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:实验题
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2%H2O2溶液 | 无 |
② | 10 mL 5%H2O2溶液 | 无 |
③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。
同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是________(填一种即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
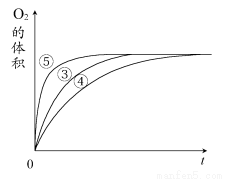
分析该图能够得出的实验结论是________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。
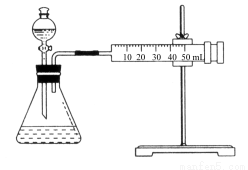
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量________或________来比较;
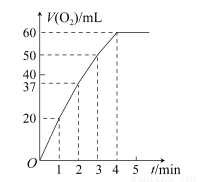
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物质的量浓度为________。(保留两位有效数字,在标准状况下测定)
Ⅲ.(1)为了加深对影响反应速率因素的认识,老师让甲同学完成下列实验:
在Ⅱ中的实验装置的锥形瓶内盛6.5 g锌粒(颗粒大小基本相同),通过分液漏斗加入40 mL 2.5 mol/L的硫酸,10 s时收集产生的H2体积为50 mL(若折合成标准状况下的H2体积为44.8mL),用锌粒来表示10s内该反应的速率为______g/s;
(2)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-1 化学反应速率练习卷(解析版) 题型:填空题
加0.1 mol MnO2粉末于50 mL过氧化氢(H2O2,ρ=1.1 g· mL-1)中,在标准状况下放出气体的体积和时间的关系如图所示。
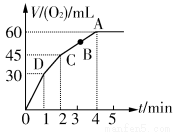
(1)实验时放出气体的总体积是_____________________________。
(2)放出一半气体所需时间为_______________________________。
(3)反应放出气体总体积的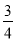 所需的时间约为__________________
所需的时间约为__________________
(4)A、B、C、D各点反应速率快慢的顺序为____________________
(5)解释反应速率变化的原因___________________________________________________
(6)计算H2O2的初始物质的量浓度____________________
(7)求反应到2 min时,H2O2的质量分数_________________________
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
将4 mol A和2 mol B放入2 L密闭容器中发生反应:2A(g)+B(g) 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是 ( )
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是 ( )
A.4 s内,v(B)=0.075 mol/(L·s)
B.当c(A)∶c(B)∶c(C)=2∶1∶2时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
如图表示某可逆反应在使用和未使用催化剂时,反应进程和能量的对应关系。下列说法一定正确的是( )
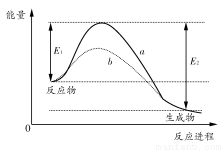
A.a与b相比,b的活化能更高
B.反应物断键吸收的总能量小于生成物成键释放的总能量
C.a与b相比,反应的平衡常数一定不同
D.a与b相比,a对应的反应速率更快
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
250°C和1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+56.76 kJ/mol,自发进行的原因是( )
A.是吸热反应 B.是放热反应 C.是熵减反应 D.熵增效应大于能量效应
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s) ΔH=-444.3 kJ·mol-1,且熵减小,在常温常压下该反应能自发进行,对反应的方向起决定作用的是 ( )
A.焓变 B.温度 C.压强 D.熵变
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 7-2 化学反应的方向和限度练习卷(解析版) 题型:选择题
某温度时,在体积为1 L的密闭容器中,A、B、C三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,B的体积百分含量与时间关系如图Ⅱ所示。则下列结论正确的是( )

A.该反应的热化学方程式为 :A(g )+3B(g) 2C(g) ΔH>0
2C(g) ΔH>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com