
科目: 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.乙酸与丙二酸互为同系物
B.不同元素的原子构成的分子只含极性共价键
C. 和
和 是中子数不同质子数相同的同种核素
是中子数不同质子数相同的同种核素
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
两种微粒含有相同的质子数和电子数,这两种微粒可能是( )
①两种不同的原子 ②两种不同元素的原子 ③一种原子和一种分子 ④一种原子和一种离子 ⑤两种不同分子 ⑥一种分子和一种离子 ⑦两种不同阳离子 ⑧两种不同阴离子 ⑨一种阴离子和一种阳离子
A.①③⑤⑥⑦⑧ B.①③⑤⑦⑧
C.①③④⑤⑦ D.全部都是
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:填空题
(1)某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是 。
(2)已知某粒子的结构示意图为: ,试回答:
,试回答:
①当x-y=10时,该粒子为 (填“原子”“阳离子”或“阴离子”)。
②当y=8时,粒子可能为(填名称) 、 、 、 、 。
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
元素信息
B其单质在常温下为双原子分子,与A可形成分子X,X的水溶液呈碱性
D其简单阳离子与X具有相同电子数,且是同周期中简单阳离子中半径最小的
E元素原子最外层比次外层少2个电子
C、F两种元素的原子最外层共有13个电子
则(1)B的原子结构示意图为 。
(2)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(3)C与D形成的化合物的化学式是 ,它的性质决定了它在物质的分类中应属于 ;请写出该化合物对应水化物电离的方程式 。
(4)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式为 。
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:填空题
短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。
请回答:
(1)X的原子结构示意图是 ;Y的元素符号是 ;Z元素的名称是 。
(2)XZ3化合物的电子式是 。
(3)X的最高价氧化物的分子式是 ;Y的最高价含氧酸的结构简式是 。
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:填空题
X、Y、Z、W是短周期的四种元素,有关他们的信息如表所示。
元素 | 部分结构知识 | 部分性质 |
X | X的单质由双原子分子构成,分子中有14个电子 | X有多种氧化物,如XO、XO2、X2O4等;通常情况下XO2与X2O4共存 |
Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
Z | Z原子的最外层电子数多于4 | Z元素的最高正化合价与最低负化合价代数和等于6 |
W | W原子的最外层电子数等于2n-3(n为原子核外电子层数) | 化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白(不能用字母X、Y、Z、W作答)。
(1)X的气态氢化物分子的电子式是 ,Z元素在周期表中的位置是 。
(2)X、Y、Z三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是 。
(3)常温时,W的硫酸盐溶液的pH (填“>”、“<”或“=”)7,理由是: (用离子方程式表示)。
(4)实验室用X的氢化物的水溶液制取W的氢氧化物的方法是(用离子方程式表示) 。
(5)25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6kJ的热量,写出该反应的热化学方程式: 。
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( )
①都是主族元素,原子的最外层电子数都大于3
②单质在反应中都只能作氧化剂
③对应的含氧酸都是强酸
④氢化物常温下都是气态,所以又叫气态氢化物
⑤气态氧化物与水反应都不会再生成气体
A.全部 B.只有①② C.只有①②③④ D.只有①②④⑤
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
如图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )
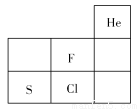
A.非金属性:F>S>Cl
B.原子半径:Cl>S>F
C.稳定性:HF>HCl>H2S
D.离子半径:Cl->S2->F-
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
元素周期表和元素周期律对化学学习具有指导意义,下列有关叙述正确的是( )
A.铅位于周期表中金属与非金属元素交界处,可做半导体材料
B.若存在简单阴离子R2-,则R一定属于第ⅥA族元素
C.S和Se属于第ⅥA族元素,H2S还原性比H2Se的强
D.元素原子最外层电子数较少的金属一定比最外层电子数较多的金属活动性强
查看答案和解析>>
科目: 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
短周期元素X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,下列说法正确的是( )
A.X的最高价氧化物对应的水化物显弱酸性
B.Y的氧化物是离子化合物
C.X的氢化物的水溶液在空气中存放不易变质
D.X的氢化物和Z的氢化物反应生成一种对热稳定的化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com