
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
关于下列各实验装置的叙述中,不正确的是( )
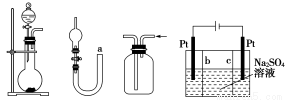
① ② ③ ④
A.图①可用于实验室制取少量NH3或O2
B.可用从a处加水的方法检验图②装置的气密性
C.实验室可用图③的方法收集Cl2或NH3
D.利用图④装置制硫酸和氢氧化钠,其中b为阴离子交换膜,c为阳离子交换膜
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.除去Cl2中少量的HCl,可将混合气体通过盛有饱和NaCl溶液的洗气瓶
B.向久置于空气的FeCl2溶液中滴入KSCN溶液,会产生Fe(SCN)3血红色沉淀
C.向某溶液中滴入稀盐酸产生使澄清石灰水变浑浊的气体,该溶液一定含有CO32-
D.实验室可采用分液法直接分离乙酸乙酯和乙醇的混合液
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
下列物质的除杂方法中,合理的是( )
①C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱石灰干燥
②K2CO3中混有的少量NaHCO3,可以用加热的方法除去
③乙烯中混有的SO2气体可以通过酸性高锰酸钾溶液除去
④金属铜中含有的少量银和锌可以通过电解精炼的方法除去
⑤H2S中混有的水蒸气用浓硫酸干燥即可
A.①④ B.②③ C.①⑤ D.④⑤
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
某酸性溶液可能含有Br-、SO42-、H2SO3、NH4+等,分别对该溶液进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是( )
A.Br- B.SO42- C.H2SO3 D.NH4+
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用如图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
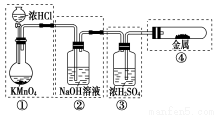
A.①② B.② C.②③ D.②③④
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。
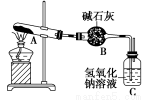
装置 | A(试管+粉末) | B | C |
反应前 | 42.0 g | 75.0 g | 140.0 g |
反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4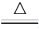 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4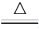 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4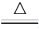 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4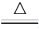 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:填空题
近年来,高锰酸钾在饮用水和工业污水处理领域的消费需求增长较快。实验室可用二氧化锰为主要原料制备高锰酸钾。其部分流程如下:

(1)第①步中采用铁坩埚而不用瓷坩埚的原因是(用化学方程式表示)_______________________________________________________________。
(2)KOH、KClO3和MnO2共熔反应生成墨绿色K2MnO4的化学方程式为________________________________________________________________。
(3)第④步通入CO2,可以使MnO42-发生反应,生成MnO4-和MnO2。则K2MnO4完全反应时,转化为KMnO4的百分率约为____________________(精确到0.1%)。
(4)第⑤步趁热过滤的目的是________________________________。
(5)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、___________、洗涤、干燥。干燥过程中,温度不宜过高,因为_________________。
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:填空题
碳酸钙常用作牙膏的摩擦剂。某同学设计了一种制备碳酸钙的方案,其流程图如下:(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨。标准状况下生成二氧化碳的体积为______________L,石灰石中碳酸钙的质量分数为______________%。
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶性滤渣的成分为________________________。
(3)第③步反应一般不采用通入CO2的主要原因是______________________,
相应的离子方程式为_____________________________________。
(4)CaCO3是一种难溶物质,25℃时其Ksp=2.8×10-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4 mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______________。
(5)某学生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下:
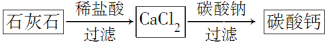
与前一方案相比较,该方案的优点是_________________________________。
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:填空题
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3、MgO、CaO等,生产工艺流程示意如图下:

(1)将菱锌矿研磨成粉的目的是____________________________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□______+□______=□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
开始沉 淀的pH | 10.4 | 6.4 |
|
|
沉淀完全 的pH | 12.4 | 8.0 |
|
|
开始溶 解的pH |
| 10.5 |
|
|
Ksp | 5.6×10-12 |
| 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目: 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:填空题
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:______C+________K2Cr2O7+________——________CO2↑+________K2SO4+________Cr2(SO4)3+________H2O。
①完成并配平上述化学方程式。
②在上述化学方程式上标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是_________________________________________________________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图(a)所示,该电池反应的离子方程式为________________________________________。
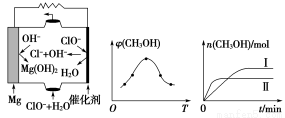
(a) (b) (c)
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH。
CH3OH(g)+H2O(g) ΔH。
①该反应的平衡常数表达式为K=________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图(b)所示,则上述CO2转化为甲醇反应的ΔH________(填“>”“<”或“=”)0。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图(c)所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com