
科目: 来源:2014年高二化学人教版选修二 2.1 获取洁净的水练习卷(解析版) 题型:填空题
水是生命之源,也是重要的环境要素之一。
(1)观察下图(Ⅰ),若用1 L水来代表地球上的总水量,要比较精确地量取地 球上的淡水量,应选择的仪器是__________。
A.100 mL烧杯 B.50 mL烧杯C.100 mL量筒 D.50 mL量筒
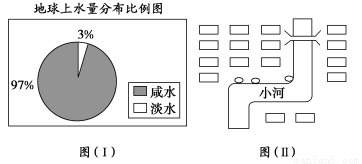
(2)图(Ⅱ)是某居民小区中垃圾收集点(小圈)的布局,它在选址上存在的问题有________;垃圾收集点选址应考虑的因素包括__________________________
(3)有人设想在住宅小区附近建立小型生活垃圾焚烧厂,其流程如图(Ⅲ)。请将图(Ⅲ)中①②③所要表达的内容填在下面的横线上。
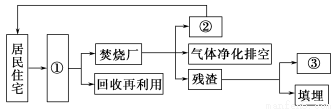
图(Ⅲ)
①______________________________;
②________________________________;
③_________________________________。
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.1 获取洁净的水练习卷(解析版) 题型:填空题
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加顺序为________,原因是___________________________________。
(3)目前常用阴、阳离子交换树脂来进行水的软化,水中的Ca2+、Mg2+与交换树脂的____________起离子交换作用。当阴离子交换树脂失效后可放入__________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是将海水通过电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
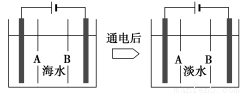
①阳离子交换膜是指__________(填“A”或“B”)。
②写出通电后阳极区的电极反应式:_________________________________;
阴极区的现象是:_________________________________________________。
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:选择题
离子膜法制烧碱示意图如下图所示,有关说法正确的是 ( )。
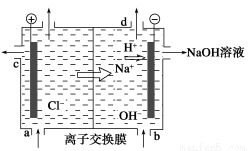
A.a口进水
B.b口进精制饱和食盐水
C.c口出的是Cl-,是由b口进入的
D.d口出的是H2
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:选择题
在氯碱工业中,原料盐中的杂质离子危害很高,能破坏离子膜,以下对Ca2+、Mg2+、Fe3+、SO42-除去顺序不合理的是 ( )。
A.BaCl2、NaOH、Na2CO3
B.BaCl2、Na2CO3、NaOH
C.NaOH、BaCl2、Na2CO3
D.Na2CO3、BaCl2、NaOH
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:选择题
氯碱工业中关于电极材料的选用,下列说法合理的是 ( )。
A.两极可用任意可导电固体材料
B.阳极必须用惰性电极
C.阴极必须用惰性电极
D.石墨阳极比金属阳极更节电
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:填空题
氢氧化钠是一种用途十分广泛的化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是__________________________________。
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是__________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽的①电解时电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来的2倍的是________________。
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:填空题
(1)电解饱和食盐水之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂和操作有a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,d.过滤,其合理的加入顺序为________(填字母代号)。
(2)电解饱和食盐水时离子交换膜的作用是_____________________________
(3)电解饱和食盐水时,如果在容积为10 L的离子交换膜电解槽中,1 min在阳极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变)________。
(4)Cl2常用于自来水的杀菌消毒,现有一种新型消毒剂ClO2,若它们在杀菌过程中还原产物均为Cl-,消毒等量的自来水,所需Cl2和ClO2的物质的量之比为________。
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:选择题
世界上60%的镁是从海水中提取的,其主要步骤如下:①把贝壳制成石灰乳 ②在海水中加入石灰乳,过滤,洗涤沉淀物 ③将沉淀物与盐酸反应,结晶、过滤 ④在氯化氢热气流中干燥晶体 ⑤电解上述晶体的熔融物。下列说法不正确的是 ( )。
A.镁元素在元素周期表中位于第3周期,ⅡA族
B.向洗涤液中滴加碳酸钠溶液可检验沉淀是否洗涤干净
C.在氯化氢热气流中干燥晶体的目的是抑制MgCl2水解
D.步骤⑤也可以采用电解该晶体水溶液的方法
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:填空题
海水中镁的总储量约为2.1×1015t,目前世界上60%的镁来自海水,工业规模海水提镁的流程如图所示:
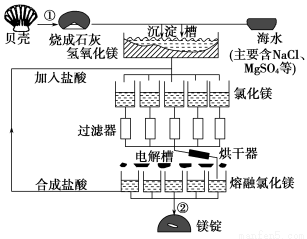
试回答下列问题:
(1)海水提镁的过程中①、②反应的化学方程式:
①_____________________________________,
②______________________________________。
(2)由氯化镁溶液制取无水氯化镁固体,其操作过程是____________________
(3)为了使MgSO4完全转化为Mg(OH)2,则加入的生石灰要过量,然后分离得Mg(OH)2沉淀,考虑Ca(OH)2溶解度,应该用________法分离。
(4)金属镁、铝的工业冶炼方法既有相似之处,又有不同之别,下表是氧化镁和氯化镁的熔沸点数据:
物质 | 氧化镁 | 氯化镁 |
熔点(℃) | 2 852 | 714 |
沸点(℃) | 3 600 | 1 412 |
工业上炼镁采用电解熔融氯化镁,而冶炼铝则用电解熔融的Al2O3,其原因是____________________________________
查看答案和解析>>
科目: 来源:2014年高二化学人教版选修二 2.2 海水的综合利用练习卷(解析版) 题型:填空题
溴的氧化性介于氯和碘之间,利用这一性质解决下面的问题。
(1)你认为:将含有下列哪种分子或离子的试剂加入到含有Br-的溶液中,可以将Br-氧化为Br2__________。
A.I2 B.I C.Cl2 D.Cl-
(2)如果把氯气缓慢地通入含有相同物质的量浓度的Br-、I-的混合溶液里,__________先被氧化,原因是_________________________________________
(3)把滤纸用淀粉和碘化钾的混合溶液浸泡,晾干后就是实验室常用的淀粉碘
化钾试纸。这种试纸润湿后遇到氯气发生的变化是_____________,原因是_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com