
科目: 来源:同步题 题型:填空题
 2NH3(g)+CO2(g)达到分解平衡:
2NH3(g)+CO2(g)达到分解平衡: NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。 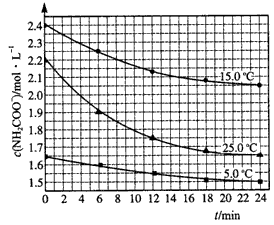
查看答案和解析>>
科目: 来源:同步题 题型:填空题
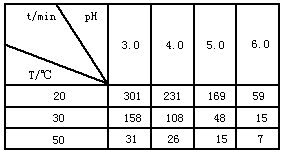
查看答案和解析>>
科目: 来源:期末题 题型:填空题
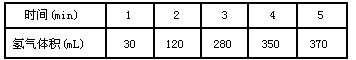
查看答案和解析>>
科目: 来源:四川省月考题 题型:单选题
[ ]
查看答案和解析>>
科目: 来源:浙江省月考题 题型:单选题
 NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是
NH3当增大压强使容器体积缩小时,化学反应速率加快,其主要原因是 [ ]
查看答案和解析>>
科目: 来源:期末题 题型:单选题
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
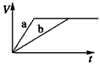
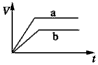
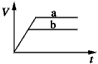
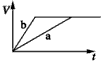
查看答案和解析>>
科目: 来源:同步题 题型:填空题
 B(g)+D(g)在4种不同条件下进行,B和D的起始浓度为0,反应物A的浓度
B(g)+D(g)在4种不同条件下进行,B和D的起始浓度为0,反应物A的浓度
查看答案和解析>>
科目: 来源:浙江省期末题 题型:单选题
查看答案和解析>>
科目: 来源:0117 期末题 题型:填空题
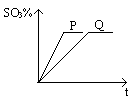
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com