
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
温度/℃ | 15 | 50 | 100 |
化学平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,向容积为2 L的密闭容器中充入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。
CH3OH(g)+H2O(g),5 min后反应达到平衡时c(CH3OH)为0.2 mol·L-1。CO2(g)的平衡物质的量浓度c(CO2)与温度关系如图所示。下列说法错误的是( )。

A.0~5 min,CO2的平均反应速率为0.04 mol·(L·min)-1
B.反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)的ΔH<0
CH3OH(g)+H2O(g)的ΔH<0
C.在T2 ℃时,若反应处于状态D,则一定有v正<v逆
D.若T1 ℃、T2 ℃时的平衡常数分别为K1、K2,则K1>K2
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g) ΔH>0;该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )。
MgO(s)+CO2(g)+SO2(g) ΔH>0;该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )。
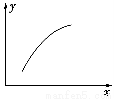
选项xy
A温度容器内混合气体的密度
BCO的物质的量CO2与CO的物质的量之比
CSO2的浓度平衡常数K
DMgSO4的质量(忽略体积)CO的转化率
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
在我国汽车尾气已成为主要的大气污染物,使用稀土等催化剂能将汽车尾气中的CO、NOx和碳氢化合物转化成无毒物质,从而减少污染。向容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入等量的NOx及C3H6,在不同温度下,发生如下反应:

①18 NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g);
9N2(g)+6CO2(g)+6H2O(g);
②18 NO2(g)+4C3H6(g) 9N2(g)+12 CO2(g)+12 H2O(g)
9N2(g)+12 CO2(g)+12 H2O(g)
分别测定不同温度时NOx的转化率,所得的曲线如图所示。下列说法正确的是( )。
A.该反应的ΔH>0
B.加入催化剂,NO(g)的转化率比NO2(g)的低
C.分离出H2O(g)可提高碳氢化合物的转化率
D.增大C3H6(g)的浓度可提高NOx的转化率,具有实际意义
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
 ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
ΔH=a kJ·mol-1。经一段时间后达到平衡。反应过程中测定的部分数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是( )。
A.反应在前20 min的平均速率为v(H2)=0.008 mol·L-1·min-1
B.保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol·L-1,则a<0
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0%
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,达到平衡前v正>v逆
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:选择题
在体积为2 L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g),图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。

A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.02 mol·L-1·min-1
B.由图乙可知,反应xA(g)+yB(g)??zC(g)的ΔH<0,且a=2
C.若在图甲所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)>v(逆)
D.200 ℃时,向容器中充入2 mol A和1 mol B,达到平衡时,A的体积分数小于0.5
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)??B(g)+C(g) ΔH=+85.1 kJ·mol-1
ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为____________________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为______________。平衡时A的转化率为__________,列式并计算反应的平衡常数K__________________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n(总)=________ mol,n(A)=________ mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为__________ mol·L-1。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
2012年11月16日,5名男孩被发现死于贵州省毕节市七星关区街头垃圾箱内,经当地公安部门初步调查,5名男孩是因在垃圾箱内生火取暖导致CO中毒而死亡。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的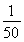 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的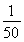 ,则吸入肺部CO的浓度不能超过________mol·L-1。
,则吸入肺部CO的浓度不能超过________mol·L-1。
(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
在不同的温度下K1、K2、K3的数值如下:
T/℃ | K1 | K2 | K3 |
700 | 1.47 | 2.38 | 0.62 |
900 | 2.15 | 1.67 |
|
请回答下列问题:
①Q1、Q2、Q3的关系式:Q3=________。
②K1、K2、K3的关系式:K3=________,根据此关系式可计算出上表中900 ℃时,K3的数值为________(精确到小数点后两位)。可进一步推断反应H2(g)+CO2(g)??CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g) CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
A.缩小容器体积 B.降低温度 C.使用催化剂 D.设法增加H2O(g)的量
E.升高温度
(3)在一定条件下,使CO和O2的混合气体13 g充分反应,所得混合气体在常温下与足量的Na2O2固体反应,结果固体增重7 g,则原混合气体中CO的质量是________g。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习江苏专用 第6讲化学反应速率和化学平衡练习卷(解析版) 题型:填空题
(1)在100 ℃恒温条件下将0.100 mol的N2O4充入体积为1 L的真空密闭容器中,发生反应:N2O4(g) 2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
2NO2(g) ΔH>0。隔一定时间对该容器内的物质进行分析,得到如下数据:
t/s c/(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/(mol·L-1) | 0.100 | a | 0.5b | 0.4b |
|
|
c(NO2)/(mol·L-1) | 0 | 0.060 | b | c1 | c2 | c3 |
请回答下列问题:
①表中a=________,在0~20 s内N2O4的平均反应速率为_______mol·(L·s)-1。
②已知100 ℃时该反应的平衡常数为0.36,则表中b、c1、c2的大小关系为________,c3=________mol·L-1,达到平衡时N2O4的转化率为________________________________。
(2)室温下,把SiO2细粉放入蒸馏水中,不断搅拌,能形成H4SiO4溶液,反应原理如下:
SiO2(s)+2H2O(l)??H4SiO4(aq) ΔH
①写出该反应的化学平衡常数K的表达式:____________________________。
②实际上,在地球的深处,由于压强很大,固体、液体都会受到影响。在一定温度下,在10 000 m以下的地球深处,上述反应的方向是________(填“正方向”、“逆方向”或“不移动”),理由是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com