
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:选择题
下列有关工业生产的叙述正确的是( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:选择题
工业上利用H2在Cl2中燃烧,所得产物再溶于水的方法制得盐酸,流程复杂且造成能量浪费。有人设想利用原电池原理直接制备盐酸的同时,获取电能,假设这种想法可行,下列说法肯定错误的是( )
A.两极材料都是石墨,用稀盐酸作电解质溶液
B.通入氢气的电极为原电池的正极
C.电解质溶液中的阳离子向通入氯气的电极移动
D.通氯气的电极反应为Cl2+2e-=2Cl-
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:选择题
下列金属的工业制法正确的是( )
A.制钛:用金属钠置换出氯化钛(TiCl4)溶液中的钛
B.炼铁:用焦炭和空气反应产生的一氧化碳在高温下还原铁矿石中的铁
C.制钠:用海水作原料制得精盐,再电解纯净氯化钠溶液得到金属钠
D.炼铜:用黄铜矿经电解精炼得到纯度为99.9%的铜
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如图所示:

已知:FeTiO3与盐酸反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是________。
(2)滤渣A的成分是________。
(3)滤液B中TiOCl42—转化生成TiO2的离子方程式是________________。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因是________________________________。

(5)反应③的化学方程式是________________________。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)做电极组成电池,其工作原理为Li4Ti5O12+3LiFePO4 Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:

金属离子含量与混合液pH、CuCl产率与混合液pH的关系图如图。

【已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7】请回答下列问题:
(1)酸浸时发生反应的离子方程式是________;析出CuCl晶体时的最佳pH在________左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为____________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70℃干燥2 h、冷却密封包装。70℃真空干燥、密封包装的目的是____________________________________________。
(4)产品滤出时所得滤液的主要分成是________,若想从滤液中获取FeSO4·7H2O晶体,还需要知道的是__________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式:______________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
红矾钠(重铬酸钠:Na2Cr2O7·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中做辅助剂,在化学工业和制药工业中也可做氧化剂,应用领域十分广泛。实验室中红矾钠可用一种铬铁矿(主要成分:FeO·Cr2O3,还含有少量的Al2O3)通过以下过程来制取。

回答下列问题:
(1)步骤Ⅰ中反应化学方程式为4FeO2·Cr2O3(s)+8Na2CO3(s)+7O2(g)=8Na2CrO4(s)+2Fe2O3(s)+8CO2(g)。
①在实验室,步骤Ⅰ应在________(填“陶瓷”或“铁”)坩埚中完成。
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是________(填字母)。
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是________________________(用化学反应方程式表示)。
(3)步骤Ⅳ中发生反应的离子方程式为________;反应完成的标志是________。
(4)利用下面的复分解反应,将红矾钠与KCl固体按1?2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl=K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)
基本实验步骤为①溶解;②________;③________;④冷却,结晶,再过滤得K2Cr2O7晶体。其中③应在________(填“高温”或“低温”)条件下进行。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
对物质净化对生产生活有很重要的意义。
(1)除去水中的Ca2+、Mg2+等阳离子,完成此目标可使用________(填材料名称)。
(2)催化还原法可以净化硝酸工业尾气,下列物质中不能用于除去尾气中氮氧化物的是________。
A.NH3 B.CH4 C.CO2 D.H2
(3)接触法制硫酸的工艺中,沸腾炉产生的炉气必须经过净化,除去其中的粉尘和________,净化后的炉气进入________(填设备名称)。
(4)煤的气化技术的主要产物是________,将煤加工以得到焦炉气、煤焦油及焦炭等产品的技术称为________。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2 Fe2++SO42—
Fe2++SO42— Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
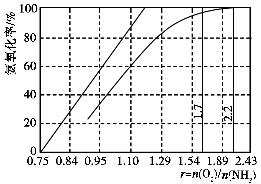
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:

(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:______________________。
(2)用碱液浸出产品比用热水更好,理由是__________________。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。为使除汞达到最佳效果,应控制条件是________________。

(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=________mol·L-1[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在________;该电极pH将________(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因______________________。
查看答案和解析>>
科目: 来源:2013-2014学年高考化学二轮复习必做训练 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com