
科目: 来源:同步题 题型:实验题
| “碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表 | ||||||||||||||||||||||||
| ||||||||||||||||||||||||
| 回答下列问题: (1)该实验的目的是_______________________。 (2)显色时间t2=_____________。 (3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为_____________(填字母) A <22.0s B 22.0~44.0s C >44.0s D 数据不足,无法判断 (4)通过分析比较上表数据,得到的结论是__________________________ |
查看答案和解析>>
科目: 来源:天津期中题 题型:单选题
查看答案和解析>>
科目: 来源:期中题 题型:填空题

查看答案和解析>>
科目: 来源:0119 期中题 题型:填空题
查看答案和解析>>
科目: 来源:0113 专项题 题型:单选题
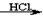 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据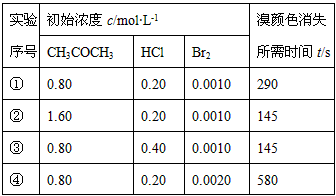
查看答案和解析>>
科目: 来源:0110 期中题 题型:单选题
查看答案和解析>>
科目: 来源:0110 期中题 题型:单选题
查看答案和解析>>
科目: 来源:0107 月考题 题型:填空题
查看答案和解析>>
科目: 来源:0114 月考题 题型:单选题
 4HCl + Si, 下列说法不合理的是
4HCl + Si, 下列说法不合理的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com