
科目: 来源:不详 题型:单选题
| A.工业生产SO3采取高压,因高压有利于SO3生成 |
| B.工业一般用较高温度合成SO3,因高温可提高SO2的转化率 |
| C.在相同温度下,有甲乙两等体积容器,甲中充入2molSO2和1molO2,乙中充入4molSO3.平衡时c1c2分别表示甲、乙中SO3对应浓度,则有c1<c2 |
| D.采用催化剂,因采用催化剂可提高SO2的转化率 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
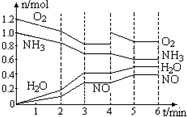
A.平衡涉及反应为4NH3+5O2 4NO+6H2O |
| B.0至3分钟气体的平均分子量在逐步减小 |
| C.第4至5分钟平衡在右移,NH3的转化率提高 |
| D.2min、4min时改变条件可能为降温、加入O2 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.当可逆反应达到平衡时,这就是此条件下这个反应所能达到的限度 |
| B.当可逆反应进行到平衡状态时,那么这个反应的正向反应的速率和逆向反应的速率都为零 |
| C.平衡状态是一种静止的状态,因为反应物和生成物的浓度都不再改变 |
| D.化学反应的限度不可以通过改变反应条件而改变 |
查看答案和解析>>
科目: 来源:不详 题型:单选题

| A.恒温恒容下:当x=1时,将1molB、1molC作为起始物达平衡后,C的体积分数是a |
| B.恒温恒容下:当x=2时,将2molC作为起始物达平衡后,C的体积分数一定小于a |
| C.恒温恒容下:当x=3时,将2molB、6molC作为起始物达平衡后,C的体积分数是a |
| D.恒温恒压下,将3molA、3molB作为起始物达平衡后,C的体积分数是a,则x可为任意正整数 |
查看答案和解析>>
科目: 来源:东城区二模 题型:多选题
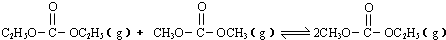
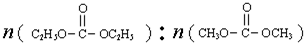
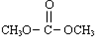
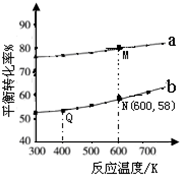
| A.曲线b所对应的投料比为3:1 |
| B.M点对应的平衡常数小于Q点 |
| C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58 |
| D.M点和Q点对应的平衡混合气体的总物质的量之比为2:1 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.实验室中配制FeCl3溶液时,应向其中加入少量浓盐酸 |
| B.合成氨工业中使用铁触媒做催化剂 |
| C.饱和FeCl3溶液滴入沸水中可制得氢氧化铁胶体 |
| D.热的纯碱溶液去油污效果好 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.随着反应的进行,正反应速率逐渐减小,最后不变 |
| B.随着反应的进行,正反应速率逐渐减小,最后为零 |
| C.随着反应的进行,逆反应速率逐渐减小,最后不变 |
| D.随着反应的进行,逆反应速率逐渐增大,最后为零 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.等于0.6mol | B.等于1mol |
| C.大于1mol | D.大于0.6mol,小于1mol |
查看答案和解析>>
科目: 来源:不详 题型:问答题
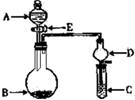
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.溴水中有平衡:Br2+H2O?HBr+HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
| B.对CO(g)+NO2(g)?CO2 (g)+NO(g) 平衡体系,增大压强可使颜色变深 |
| C.工业上合成SO3,使用催化剂 |
| D.合成 NH3反应,在较高温度下进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com