
科目: 来源:不详 题型:单选题
| A.K越大,达到平衡时,反应进行的程度越小 |
| B.K越小,达到平衡时,反应物的转化率越大 |
| C.K随反应物浓度改变而改变 |
| D.K随温度改变而改变 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.K值越大SO2转化率越大 |
| B.减小压强K值减小 |
| C.升高温度K值增大 |
| D.增大SO2的转化率K值一定增大 |
查看答案和解析>>
科目: 来源:海南 题型:问答题
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.写成2aA+2bB?2cC,△H、K值均扩大了一倍 |
| B.写成2aA+2bB?2cC,△H扩大了一倍,K值保持不变 |
| C.写成cC?aA+bB,△H、K值变为原来的相反数 |
| D.写成cC?aA+bB,△H变为原来的相反数,K值变为倒数 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.c(H+)随着温度的升高而降低 |
| B.在35℃时,纯水中c(H+)>c(OH-) |
| C.水的电离度α(25℃)>α(35℃) |
| D.水的电离过程是吸热过程 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.K=[c(C)?c(H2O)]/[c(CO)?c(H2)] | B.K=[c(CO)?c(H2)]/[c(C)?c(H2O)] |
| C.K=[c(H2O)]/[c(CO)?c(H2)] | D.K=[c(CO)?c(H2)/[c(H2O)]] |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.正向移动 | B.逆向移动 | C.达到平衡 | D.不一定 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.50 | B.0.02 | C.100 | D.无法确定 |
查看答案和解析>>
科目: 来源:西城区一模 题型:问答题
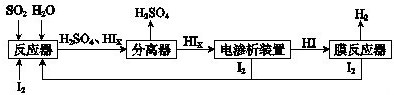
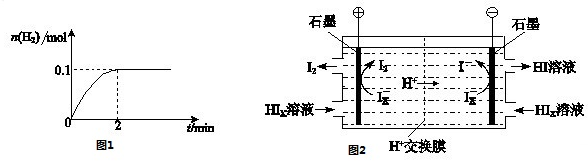
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com