
科目: 来源:模拟题 题型:单选题
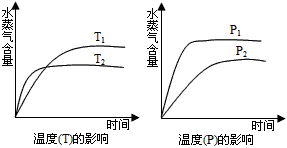
 pC(g)+qD(g)反应过程中,当其他条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。 下列叙述正确的是
pC(g)+qD(g)反应过程中,当其他条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。 下列叙述正确的是 
查看答案和解析>>
科目: 来源:辽宁省同步题 题型:填空题
 2NO(g),是导致汽车尾气中含有NO的原因之一。
2NO(g),是导致汽车尾气中含有NO的原因之一。
 N2(g)+O2(g)为(填“吸热”或“放热”)___________反应。
N2(g)+O2(g)为(填“吸热”或“放热”)___________反应。  N2(g)+O2(g) 已达到平衡的是__________(填序号)
N2(g)+O2(g) 已达到平衡的是__________(填序号) 查看答案和解析>>
科目: 来源:云南省期中题 题型:单选题
 2Z(g),减小压强时,对反应产生的影响是
2Z(g),减小压强时,对反应产生的影响是 查看答案和解析>>
科目: 来源:专项题 题型:填空题


查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。 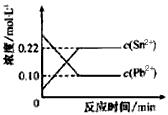
查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
 SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如所示。由图可得出的正确结论是 
查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
 2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
2HBr(g) ΔH<0,平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是 查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
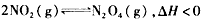 反应相同时间后,分别测定体系中NO,的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是
反应相同时间后,分别测定体系中NO,的百分含量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是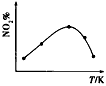



查看答案和解析>>
科目: 来源:专项题 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com