
科目: 来源:海南省高考真题 题型:单选题

 2Z,其平衡常数为1600
2Z,其平衡常数为1600 查看答案和解析>>
科目: 来源:模拟题 题型:填空题
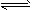 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
查看答案和解析>>
科目: 来源:模拟题 题型:单选题

查看答案和解析>>
科目: 来源:模拟题 题型:推断题
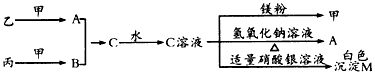
查看答案和解析>>
科目: 来源:模拟题 题型:不定项选择题
 C(g)+D(g);△H <0。现将l molA和2 mol B加入甲容器中,将2 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H <0。现将l molA和2 mol B加入甲容器中,将2 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
查看答案和解析>>
科目: 来源:模拟题 题型:单选题
 2C(g);△H<0,下列说法错误的是
2C(g);△H<0,下列说法错误的是
查看答案和解析>>
科目: 来源:北京期末题 题型:单选题
 Y(g)+W(g)的进行情况。其中实验I、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol/L,c(Y) =c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是
Y(g)+W(g)的进行情况。其中实验I、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol/L,c(Y) =c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是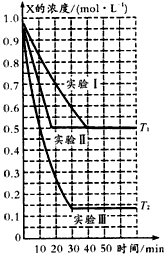
查看答案和解析>>
科目: 来源:模拟题 题型:单选题
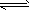 cC(g)+ dD(g),C物质的浓度(c)与温度、压强的关系如图所示,下列判断正确的是
cC(g)+ dD(g),C物质的浓度(c)与温度、压强的关系如图所示,下列判断正确的是
查看答案和解析>>
科目: 来源:模拟题 题型:单选题
 CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是查看答案和解析>>
科目: 来源:北京期末题 题型:单选题
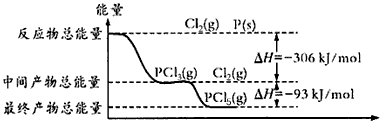
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com