
科目: 来源:同步题 题型:不定项选择题
 NH4++OH-,下列叙述正确的是
NH4++OH-,下列叙述正确的是 查看答案和解析>>
科目: 来源:浙江省高考真题 题型:填空题
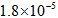 ,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=
,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Kap(CaF2)=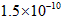
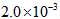 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到 c(HF)、c(F-)与溶液pH的变化关系,如下图(左)所示
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到 c(HF)、c(F-)与溶液pH的变化关系,如下图(左)所示

 mol·L-1 HF溶液与
mol·L-1 HF溶液与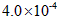 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生。 查看答案和解析>>
科目: 来源:0105 期末题 题型:单选题

查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
A.K=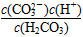
B.K=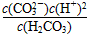
C.K1=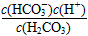
D.K2=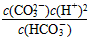
查看答案和解析>>
科目: 来源:同步题 题型:填空题
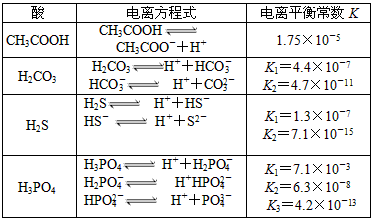
查看答案和解析>>
科目: 来源:山东省高考真题 题型:填空题

查看答案和解析>>
科目: 来源:月考题 题型:不定项选择题
[ ]
查看答案和解析>>
科目: 来源:0114 月考题 题型:单选题
[ ]
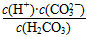
查看答案和解析>>
科目: 来源:同步题 题型:填空题
 H++A-,则K=
H++A-,则K= 。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)
。式中:K为电离平衡常数,只与温度有关,c为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(25 ℃)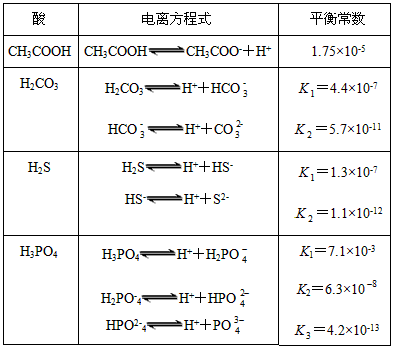
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com