
科目: 来源:河北省期末题 题型:单选题
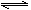 H++B2-,③HB-+
H++B2-,③HB-+ H2B+OH- 且溶液中c(H+)>c(OH-),则下列说法一定正确的是
H2B+OH- 且溶液中c(H+)>c(OH-),则下列说法一定正确的是查看答案和解析>>
科目: 来源:山东省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:专项题 题型:单选题
查看答案和解析>>
科目: 来源:丰台区一模 题型:单选题
| A.滴定盐酸的曲线是图2 |
| B.达到B、D状态时,两溶液中离子浓度均为 c(Na+)=c(A-) |
| C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl) |
| D.当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-)>c(Na+)>c(H+)>c(OH-) |
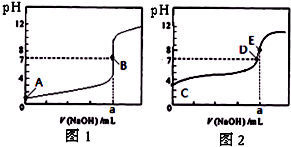
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
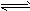 2HR1+Na2CO3;HR和HR1的酸性强弱比较,正确的是
2HR1+Na2CO3;HR和HR1的酸性强弱比较,正确的是 查看答案和解析>>
科目: 来源:广东省期末题 题型:单选题
查看答案和解析>>
科目: 来源:湖北省期中题 题型:单选题
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
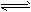 NH4++NH2-。对该体系的说法中错误的是
NH4++NH2-。对该体系的说法中错误的是 [ ]
查看答案和解析>>
科目: 来源:专项题 题型:填空题
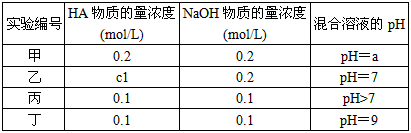
查看答案和解析>>
科目: 来源:长宁区二模 题型:多选题
| 电离常数(25℃) |
| HF: Ki=3.6×10-4 |
| H3PO4: Ki1=7.5×10-3, Ki2=6.2×10-8, Ki3=2.2×10-13 |
| A.在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B.少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C.同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D.结合H+的能力:PO43->HPO42->F- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com