
科目: 来源:清远模拟 题型:单选题
| A.在NaHCO3溶液中一定有:c(Na+)+c(H+)=c (HCO3-)+c (CO32-)+c (OH-) |
| B.0.1 mol?L-1的NaHS溶液中离子浓度关系:c(OH-)=c (H+)-c(S2-)+c(H2S) |
| C.NaOH与CH3COOH混合液中,可能出现:c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| D.将标况下的2.24LCO2通入150mL 1mol/LNaOH溶液中:c(HCO3-)<c(CO32-) |
查看答案和解析>>
科目: 来源:北京期末题 题型:单选题
查看答案和解析>>
科目: 来源:安徽省高考真题 题型:单选题
 F-(aq)+H+(aq) △H=+10.4kJ/mol
F-(aq)+H+(aq) △H=+10.4kJ/mol查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.盐酸的物质的量浓度为1mol/L |
| B.在①、②之间的任意一点:c(Cl-)>c(NH4+),c(H+)>c(OH-) |
| C.在点②所示溶液中:c(NH4+)=c(Cl-)>c(OH-)=c(H+),且V<20 |
| D.在点③所示溶液中:由水电离出的c(OH-)>10-7mol/L |
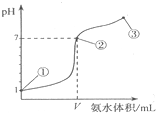
查看答案和解析>>
科目: 来源:专项题 题型:单选题
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.0.01 mol?L-1的CH3COOH与pH=12的NaOH溶液等体积混合 |
| B.CH3COOH溶液与NaOH溶液混合后所得溶液的pH=7 |
| C.0.2 mol?L-1的CH3COOH溶液与0.1 mol?L-1的NaOH溶液等体积混合 |
| D.0.1 mol?L-1的CH3COOH溶液与等物质的量浓度、等体积的NaOH溶液混合 |
查看答案和解析>>
科目: 来源:辽宁省期中题 题型:单选题
[ ]
查看答案和解析>>
科目: 来源:同步题 题型:填空题
查看答案和解析>>
科目: 来源:模拟题 题型:单选题
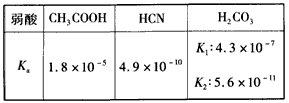
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com