
科目: 来源:模拟题 题型:单选题
查看答案和解析>>
科目: 来源:同步题 题型:单选题
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源:不详 题型:问答题
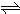
查看答案和解析>>
科目: 来源:安徽省模拟题 题型:填空题
 Cu2O + H2↑。阳极反应式为_________;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式___________________。
Cu2O + H2↑。阳极反应式为_________;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式___________________。 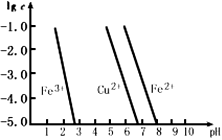
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.KSP(AB2)小于KSP(CD),则物质AB2的溶解度一定小于物质CD的溶解度 |
| B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的KSP增大 |
| C.在氯化银的沉淀溶解平衡体系中,加入碘化钾固体,氯化银沉淀可转化为碘化银沉淀 |
| D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动 |
查看答案和解析>>
科目: 来源:专项题 题型:填空题

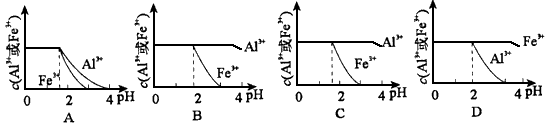
查看答案和解析>>
科目: 来源:专项题 题型:不定项选择题
[ ]
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.两清液混合,AgCl和AgI都沉淀 |
| B.向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大 |
| C.若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 |
| D.若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com