
科目: 来源:不详 题型:问答题

| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
查看答案和解析>>
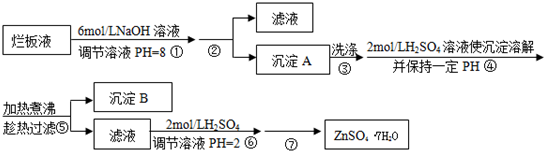
科目: 来源:不详 题型:填空题
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe3+ | 1.9 | 3.2 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.Fe3+ 已经沉淀完全 | B.Cr3+已经沉淀完全 |
| C.Zn2+ 已经开始沉淀 | D.Mg2+还没开始沉淀 |
查看答案和解析>>
科目: 来源:不详 题型:多选题
| A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5 |
| B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5 |
| C.向溶液中通入Cl2,在通入NH3调节至pH4-5 |
| D.向溶液中通入H2O2,再加入CuO粉末调节至pH4-5 |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.AgCl、AgBr、AgI | B.AgI、AgBr、AgCl |
| C.AgBr、AgCl、AgI | D.三种沉淀同时析出 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
查看答案和解析>>
科目: 来源:成都模拟 题型:单选题
| A.除去溶液中Ag+加盐酸盐比硫酸盐好 |
| B.加入H20,溶解平衡不移动 |
| C.用NaCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失 |
| D.反应2AgCl+Na2S═Ag2S+2NaCl说明溶解度:AgCl>Ag2S |
查看答案和解析>>
科目: 来源:不详 题型:单选题
| A.向饱和AgCl水溶液中加入饱和NaCl溶液,c(Cl-)增大,AgCl的溶度积增大 |
| B.将难溶电解质放入纯水中,溶解达平衡时,电解质离子的浓度的乘积就是该物质的溶度积 |
| C.向含有AgCl固体的溶液中加入适量的水使AgCl溶解,重新达到平衡时,AgCl的溶度积不变,其溶解度也不变 |
| D.AgCl的Ksp=1.8×10-10mol2?L-2,则在任何含AgCl固体的溶液中,c(Ag+)=c(Cl-)且Ag+与Cl-浓度的乘积等于1.8×10-10mol2?L-2 |
查看答案和解析>>
科目: 来源:不详 题型:填空题
| 物质 | FeSO二 | H八SO二 | Ag八SO二 | Al八(SO二)八 | 污泥 |
| 质量分数/(%) | 15.六 | 7.六 | 六.二六 | 六.3二 | 5.六 |
| 温度/℃ | 六 | 1六 | 八六 | 3六 | 二六 | 5六 |
| FeSO二溶液度(g) | 15.6 | 八六.5 | 八6.5 | 3八.9 | 二六.八 | 二8.6 |
| Al八(SO二)3溶解度(g) | 31.八 | 33.5 | 36.二 | 二六.二 | 二5.7 | 5八.八 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com