
科目: 来源:同步题 题型:不定项选择题
[ ]
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
查看答案和解析>>
科目: 来源:同步题 题型:不定项选择题
查看答案和解析>>
科目: 来源:同步题 题型:填空题
 5Ca2++3PO43-+OH-,进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是______________________。已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:__________________________。根据以上原理,请你提出一种其他促进矿化的方法:____________________________。
5Ca2++3PO43-+OH-,进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是______________________。已知Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固,请用离子方程式表示,当牙膏中配有氟化物添加剂后能防止龋齿的原因:__________________________。根据以上原理,请你提出一种其他促进矿化的方法:____________________________。 查看答案和解析>>
科目: 来源:同步题 题型:填空题
查看答案和解析>>
科目: 来源:同步题 题型:填空题
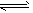 NH3·H2O+H+,且Mg(OH)2(s)
NH3·H2O+H+,且Mg(OH)2(s)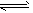 Mg2++2OH-;又H++OH-=H2O,所以Mg(OH)2溶解平衡向右移动,促进
Mg2++2OH-;又H++OH-=H2O,所以Mg(OH)2溶解平衡向右移动,促进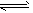 Mg2++2OH-;NH4++OH-=NH3·H2O,所以所以Mg(OH)2溶解平衡向右移动,促进
Mg2++2OH-;NH4++OH-=NH3·H2O,所以所以Mg(OH)2溶解平衡向右移动,促进查看答案和解析>>
科目: 来源:同步题 题型:填空题
查看答案和解析>>
科目: 来源:同步题 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com