
科目: 来源:湖北省模拟题 题型:单选题
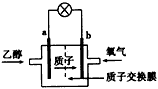
查看答案和解析>>
科目: 来源:湖北省模拟题 题型:填空题

查看答案和解析>>
科目: 来源:湖北省模拟题 题型:单选题

查看答案和解析>>
科目: 来源:湖北省模拟题 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2 
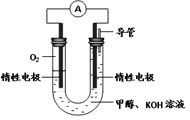
查看答案和解析>>
科目: 来源:山东省模拟题 题型:填空题
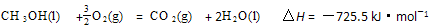
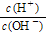 = 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为_________;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1 氨水V2 L混合,若混合溶液pH = 7,则V1 和V2 的关系为:V1________ V2 (填“>”、“<”或“=”)。
= 1×10- 6 ,则该溶液的pH为____,溶液中的溶质电离出的阳离子浓度约为_________;将 pH = 4的盐酸溶液V1 L与 0.01 mol·L-1 氨水V2 L混合,若混合溶液pH = 7,则V1 和V2 的关系为:V1________ V2 (填“>”、“<”或“=”)。查看答案和解析>>
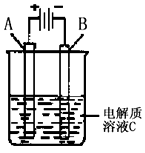
科目: 来源:四川省模拟题 题型:单选题
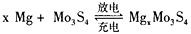 ,在镁原电池放电时,下列说法错误的是
,在镁原电池放电时,下列说法错误的是 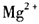 向正极迁移
向正极迁移 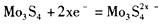
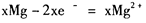
查看答案和解析>>
科目: 来源:安徽省模拟题 题型:单选题
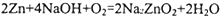 ,下列有关锌-空气电池说法正确的是
,下列有关锌-空气电池说法正确的是 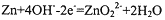
查看答案和解析>>
科目: 来源:模拟题 题型:填空题
 H2+I2
H2+I2  CH3OH(g) 分析该反应并回答下列问题:
CH3OH(g) 分析该反应并回答下列问题: 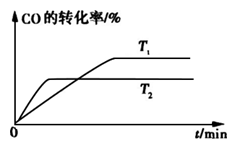

查看答案和解析>>
科目: 来源:湖北省模拟题 题型:单选题
查看答案和解析>>
科目: 来源:广东省月考题 题型:不定项选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com