
科目: 来源:江苏高考真题 题型:不定项选择题
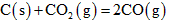 不能自发进行,则该反应的
不能自发进行,则该反应的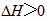
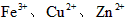 的氧化性依次减弱
的氧化性依次减弱 查看答案和解析>>
科目: 来源:江苏高考真题 题型:不定项选择题
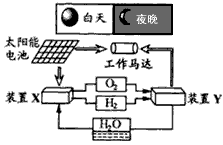
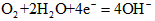
查看答案和解析>>
科目: 来源:江苏高考真题 题型:填空题
 的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池已被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过 、
、 与
与 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。 和
和 溶液直接混合的原因是___________________。
溶液直接混合的原因是___________________。 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的 的导电性能外,还能______________________。
的导电性能外,还能______________________。 及少量Al、Fe等)可通过下列实验方法回收钴、锂。
及少量Al、Fe等)可通过下列实验方法回收钴、锂。 
 被氧化成
被氧化成 ,
, 在溶解过程中反应的化学方程式为__________________________________。
在溶解过程中反应的化学方程式为__________________________________。  在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为____________。(填化学式);在350~400℃范围内,剩余固体的成分为______________。(填化学式)。
在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为____________。(填化学式);在350~400℃范围内,剩余固体的成分为______________。(填化学式)。 
查看答案和解析>>
科目: 来源:浙江省高考真题 题型:单选题

查看答案和解析>>
科目: 来源:安徽省期末题 题型:单选题
查看答案和解析>>
科目: 来源:期末题 题型:单选题
查看答案和解析>>
科目: 来源:0119 期末题 题型:单选题
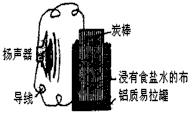
查看答案和解析>>
科目: 来源:0127 期末题 题型:单选题
查看答案和解析>>
科目: 来源:期末题 题型:单选题
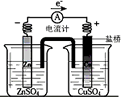
查看答案和解析>>
科目: 来源:0115 期末题 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com