
科目: 来源:陕西省模拟题 题型:填空题
 CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ 
 CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。查看答案和解析>>
科目: 来源:山东省模拟题 题型:填空题
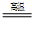 TiCl4+2CO
TiCl4+2CO 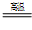 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因是____________(用化学方程式说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因是____________(用化学方程式说明)。  。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。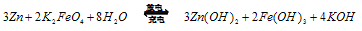 则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。
则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。 查看答案和解析>>
科目: 来源:北京期中题 题型:单选题
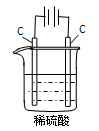
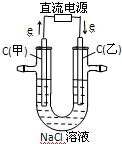
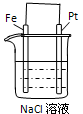

查看答案和解析>>
科目: 来源:山东省模拟题 题型:填空题

查看答案和解析>>
科目: 来源:浙江省模拟题 题型:单选题
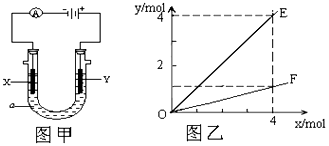
查看答案和解析>>
科目: 来源:期中题 题型:单选题
查看答案和解析>>
科目: 来源:期中题 题型:单选题
查看答案和解析>>
科目: 来源:期中题 题型:单选题
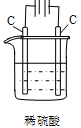
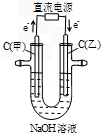
 Cu2++H2↑
Cu2++H2↑ 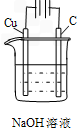
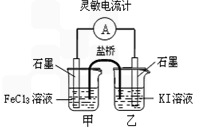
查看答案和解析>>
科目: 来源:期中题 题型:单选题
 NiOOH+MH 下列叙述正确的是
NiOOH+MH 下列叙述正确的是 查看答案和解析>>
科目: 来源:0115 期末题 题型:单选题
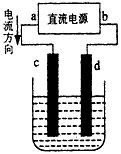
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com