
科目: 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:选择题
在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
A.n(Ca2+)增大 B.c(Ca2+)不变 C.c(OH-)增大 D.n(OH-)不变
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:选择题
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )
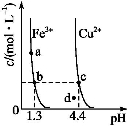
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:选择题
某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:选择题
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是( )
A.向饱和AgCl水溶液中加入盐酸,Ksp变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl的溶解度大于AgI的
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:选择题
下列说法正确的是( )
A.向饱和食盐水中加入少量的浓盐酸,看不到明显的现象
B.将硫酸铜溶液与碳酸钠溶液混合,得到的沉淀是以Cu(OH)2为主,说明了在相同条件下Cu(OH)2的溶解度比CuCO3的更小
C.在0.01 mol·L-1 NaCl溶液中加入少量的AgNO3溶液,有白色沉淀生成,接着向上述溶液中加入足量的浓氨水,白色沉淀不会溶解
D.CaCO3溶液的导电能力很弱,是因为CaCO3是弱电解质,存在如下电离平衡:CaCO3 Ca2++ CO32-
Ca2++ CO32-
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:简答题
试利用平衡移动原理解释下列事实:
(1)FeS不溶于水,但能溶于稀盐酸中;
(2)CaCO3难溶于稀硫酸,却能溶于醋酸中;
(3)分别用等体积的蒸馏水和0.010 mol·L-1硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量。
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:填空题
(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,= 。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:填空题
已知氨水与醋酸的电离程度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+H2O NH3·H2O+H+②
NH3·H2O+H+②
H++OH- H2O③
H2O③
由于N水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:
Mg(OH)2(s) Mg2+(aq)+2OH-(aq)①
Mg2+(aq)+2OH-(aq)①
N+OH- NH3·H2O②
NH3·H2O②
由于NH4Cl电离出的N与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3·H2O
(2)请你说明丙同学作出该选择的理由是 。
(3)丙同学将所选试剂滴入Mg(OH)2悬浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)4.2.2燃料电池试卷(解析版) 题型:选择题
氢氧燃料电池的突出优点是把化学能直接转变为电能,而不经过热能这一中间形式,已用于宇宙飞船及潜艇中,其电极反应为:
负极:2H2+4OH--4e- 4H2O 正极:O2+2H2O+4e-
4H2O 正极:O2+2H2O+4e- 4OH-
4OH-
所产生的水还可作为饮用水,今欲得常温下1 L水,则电池内电子转移的物质的量约为( )
A.8.9×10-3 mol
B.4.5×10-2 mol
C.1.1×102 mol
D.5.6×10 mol
查看答案和解析>>
科目: 来源:2015安徽望江中学同步课时练(人教选修4)4.2.2燃料电池试卷(解析版) 题型:选择题
质子交换膜燃料电池(PEMFC)常作为电动汽车的动力源。该燃料电池以氢气为燃料,空气为氧化剂,铂作催化剂,导电离子是H+。下列对该燃料电池的描述中正确的是( )
①正极反应为:O2+4H++4e- 2H2O
2H2O
②负极反应为:2H2-4e- 4H+
4H+
③总的化学反应为:2H2+O2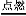 2H2O
2H2O
④氢离子通过电解质向正极移动
A.①②③ B.②③④ C.①②④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com