
科目: 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用。
(1)与N3-含有相同电子数的三原子分子的空间构型是 。
(2)Cu具有良好的导电、导热和延展性,请解释Cu具有导电性的原因 。
(3)在Cu的催化作用下,乙醇可被空气氧化为乙醛,乙醛分子中碳原子的杂化方式是__________,乙醛分子中H—C—O的键角__________乙醇分子中的H—C—O的键角(填“大于”、“等于”或“小于”)。
(4)Cu+的核外电子排布式为 ,其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu2O,试从结构角度解释高温下CuO为何会生成Cu2O 。
(5)[Cu(H2O)4]2+为平面正方形结构,其中的两个H2O被Cl-取代有两种不同的结构,试画出[Cu(H2O)2(Cl)2]具有极性的分子的结构式 。
(6)Cu3N的晶胞结构下图所示:
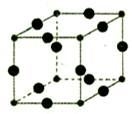
N3-的配位数为__________,Cu+半径为apm,N3-半径为b pm,Cu3N的密度__________g/cm3。(阿伏加德罗为常数用NA表示)
查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入 (填设备名称),其主要目的是 。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快 二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1)
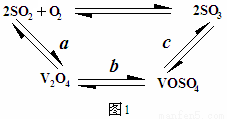
其中a、c二步反应的化学方程式可表示为: 、 。
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(P)的关系如图2所示,
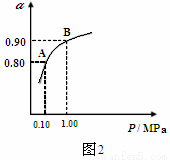
则:将2.0mol SO2和1.0mol O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M Pa,A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是: 。
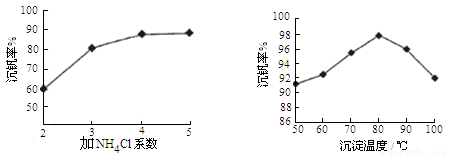
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣,查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水。该工艺的流程如图如下:

则反应①②③④中属于氧化还原反应的是 (填数字序号),反应①的离子方程式为 ,该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图试建议控制氯化铵系数和温度: 、 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
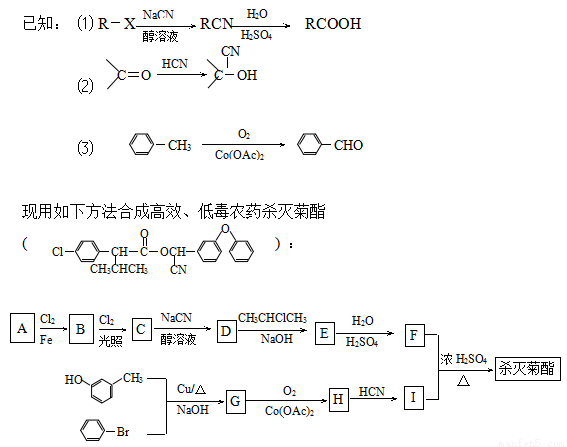
(1)原料A是苯的最简单的同系物,其名称是 ;合成G的反应类型是 。
(2)写出B的结构简式 。
(3)写出反应D→E的化学方程式: 。
(4)杀灭菊酯的核磁共振氢谱共有 种峰。
(5)氨基酸X与I互为同分异构体,且X是萘(  )的一取代物,含有碳碳叁键,X所有可能的结构共有 种。高聚物Y是由X通过肽键连接而成,Y的结构简式是 (只要求写一种)。
)的一取代物,含有碳碳叁键,X所有可能的结构共有 种。高聚物Y是由X通过肽键连接而成,Y的结构简式是 (只要求写一种)。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
能源、材料和信息是现代社会的三大“支柱”。
(1)目前,利用金属或合金储氢的研究已取得很大进展,下图是一种镍基合金储氢后的晶胞结构图。

① Ni原子的价电子排布式是 。
② 该合金储氢后,含1mol La的合金可吸附H2的数目为 。
(2)南师大结构化学实验室合成了一种多功能材料——对硝基苯酚水合物(化学式为C6H5NO3·1.5H2O)。实验表明,加热至94℃时该晶体能失去结晶水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
①晶体中四种基本元素的电负性由大到小的顺序是 。
②对硝基苯酚水合物失去结晶水的过程中,破坏的微粒间作用力是 。
(3)科学家把NaNO3和Na2O在一定条件下反应得到一种白色晶体,已知其中阴离子与SO42-互为等电子体,且该阴离子中的各原子的最外层电子都满足8电子稳定结构。该阴离子的电子式是 ,其中心原子N的杂化方式是 。
(4)在金刚石晶体的一个晶胞(如图1)中,含有 个碳原子。在二氧化硅晶体的一个晶胞中,含有 个化学键。原子晶体能否形成最密堆积结构,原因是 。
(5)铁晶体的晶胞结构(如图2):若铁原子的半径是r cm,则铁的密度是 。

查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。二氧化硫有毒,并且是形成酸雨的主要气体。无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要。完成下列填空:
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是 (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g(保留一位小数)。
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。
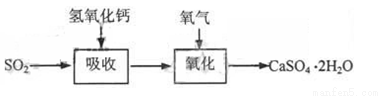
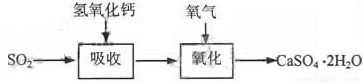
石灰—石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为:SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
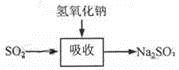
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 。和碱法相比,石灰-石膏法的优点是 ,缺点是 。
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
共聚法可改进有机高分子化合物的性质,高分子聚合物P的合成路线如下:
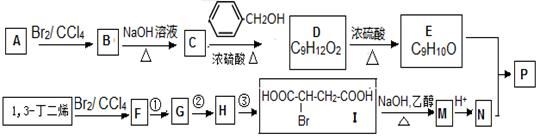
(1)B的名称为_____________,E中所含官能团的名称为 ;
(2)I由F经①~③合成,F可以使溴水褪色。
a.①的化学方程式是
b.②的反应试剂是
c.③的反应类型是
(3)下列说法正确的是
a.C可与水任意比例混合
b.A与1,3-丁二烯互为同系物
c.由I生成M时,1mol最多消耗3molNaOH
d.N不存在顺反异构体
(4)写出E与N按照物质的量之比为1:1发生共聚生成P的化学反应方程式 高聚物P的亲水性比由E形成的聚合物_____(填“强、弱”)。
(5)D的同系物K比D分子少一个碳原子,K 有多种同分异构体,符合下列条件的K的同分异构体有 种。写出其中核磁共振氢谱为1:2:2:2:3的一种同分异构体的结构简式 。
a.苯环上有两种等效氢
b.能与氢氧化钠溶液反应
c.一定条件下1mol该有机物与足量金属钠充分反应,生成1molH2
查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
铜单质及其化合物在很多领域中都有重要的用途。请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
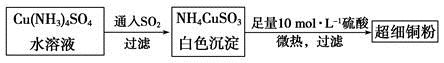
①NH4CuSO3中金属阳离子的核外电子排布式为______。N、O、S三种元素的第一电离能大小顺序为__________________(填元素符号)。
②SO42-的空间构型为________。
(2)某学生用硫酸铜溶液与氨水做了一组实验,CuSO4溶液中加氨水生成蓝色沉淀,再加氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体,请解释加入乙醇后析出晶体的原因_________;在该晶体中存在的化学键的种类有_________。
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上Cl原子的杂化轨道类型为________。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为____________。

用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜原子的直径约为__________pm,阿伏加德罗常数的值为________[已知Ar(Cu)=63.5]。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习3(解析版) 题型:填空题
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。
(1)含有较多 的水称为硬水,硬水加热后产生沉淀的离子方程式为____________(写出生成一种沉淀物的即可)。
(2)下图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
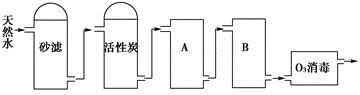
①活性炭的作用是____________;O3消毒的优点是___________。
②A、B中放置的物质名称分别是A_________;B__________。A、B中放置的物质是否可以互换?请说明原因__________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留, 从而获得纯净水的方法称为 。电渗析法净化水时, 使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时, 最简单易行的方法是测定水的 。
(5)某城市用水中,c(Ca2+)为1.0×10-3mol/L, c(Mg2+)为5.0×10-4mol/L,c(HCO3-)为8.0×10-4mol/L。如用药剂软化该水1000L,应加入Ca(OH) 2 g, Na2CO3__________ g
查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
对甲基苯甲酸乙酯(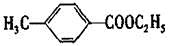 )是用于合成药物的中间体。请根据下列转化关系回答有关问题
)是用于合成药物的中间体。请根据下列转化关系回答有关问题
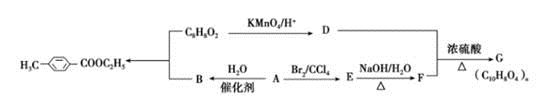
(1)D中含有官能团的名称是________,A-E的反应类型为______。
(2)G的结构简式为_______。
(3)写出1种属于酯类且苯环上只有一个取代基的C8H8O2的同分异构体 。
(4)丁香酚(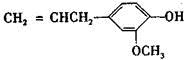 )是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是________(填序号)。
)是对甲基苯甲酸乙酯的同分异构体,下列物质与其能发生反应的是________(填序号)。
A.NaOH溶液 B.NaHCO3溶液 C.KMnO4/H+ D.FeCl3溶液
(5)写出合成对甲基苯甲酸乙酯的化学方程式_______________。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。
(2)Br原子的M层核外电子排布式为_________。
(3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。
(4)CCl4分子中碳原子的杂化方式为______,NF3分子的空间构型为_______。
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。
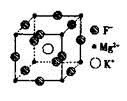
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com