
科目: 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
某研究小组在实验室用重晶石(主要成分BaSO4)对工业生产BaS进行模拟实验。BaS是可溶盐,在工业生产中,它是制备其他钡盐的中间产物。已知:
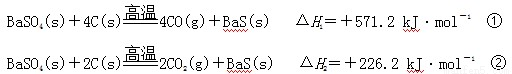
下列说法不正确的是
A.上述反应中BaSO4均作氧化剂
B.反应C(g)+CO2(g) 2CO(g)的ΔH3>+172.5 kJ·mol-1
2CO(g)的ΔH3>+172.5 kJ·mol-1
C.实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温
D. 以BaS作为沉淀剂,用于铅和汞沉淀的转化
查看答案和解析>>
科目: 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
反应A(g)+B(g)—→C(g) ΔH,分两步进行:①A(g)+B(g)—→X(g) ΔH1;②X(g)—→C(g) ΔH2。反应过程中能量变化如图所示,E1表示A+B—→X的活化能,下列说法正确的是
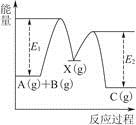
A.ΔH1=ΔH-ΔH2>0
B.X是反应A(g)+B(g)—→C(g)的催化剂
C.E2是反应②的活化能
D.ΔH=E1-E2
查看答案和解析>>
科目: 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:选择题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1 0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
请参考题中图表,已知E1=134 kJ·mol-1、E2=368 kJ·mol-1,根据要求回答问题:


(1)图Ⅰ是1 mol NO2(g)和1 mol CO(g)反应生成CO2和NO过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是 (填“增大”、“减小”或“不变”,下同),ΔH的变化是 。请写出NO2和CO反应的热化学方程式: 。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44 kJ·mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为 。
(3)如表所示是部分化学键的键能参数:
化学键 | P—P | P—O | O===O | P===O |
键能/kJ·mol-1 | a | b | c | x |
已知白磷的燃烧热为d kJ·mol-1,白磷及其完全燃烧的产物的结构如图Ⅱ所示,则表中x= kJ·mol-1(用含a、b、c、d的代表数式表示)。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
根据下列条件计算有关反应的焓变:
(1)已知:
Ti(s)+2Cl2(g)===TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)===2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)===Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)===Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知下列反应数值:
序号 | 化学反应 | 反应热 |
① | Fe2O3(s)+3CO(g)=== 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
② | 3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol-1 |
③ | Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
④ | FeO(s)+CO(g)===Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4= kJ·mol-1。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) ===2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s) ===2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
则2Fe2O3(s)+3C(s) ===4Fe(s)+3CO2(g) ΔH= kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g) ===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学盖斯定律及其应用(解析版) 题型:填空题
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+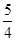 O2(g)===
O2(g)===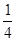 P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
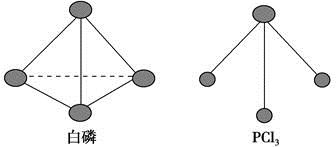
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
下列有关物质的性质和应用均正确的是
A.NH3能氧化氮氧化物,可用于汽车尾气净化
B.瓷坩埚能耐高温,可用于加热分解石灰石
C.Fe在O2中的燃烧产物可用于制红色涂料
D.Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂
查看答案和解析>>
科目: 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
下列化学物质在实际生产生活和科技等方面的应用不正确的是
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在气化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
查看答案和解析>>
科目: 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物。下表各组物质之间通过一步反应不能实现如图所示转化的是
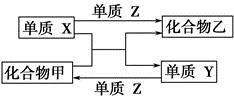
选项 | X | Y | Z | 甲 | 乙 |
A | H2 | Si | Cl2 | SiCl4 | HCl |
B | Mg | C | O2 | CO2 | MgO |
C | Zn | Fe | Cl2 | FeCl2 | ZnCl2 |
D | Cl2 | N2 | H2 | NH3 | HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com