
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
已知298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
2SO3(g);△H=-197kJ·mol-1。现有同一温度下的三个体积相同的密闭容器,在第一个容器中通入2molSO2和1molO2,达到平衡时,反应放出的热量为Q1;向第二个密闭容器中通入1molSO2和0.5molO2,达到平衡时放出的热量为Q2;在第三个密闭容器中通入1molSO2、0.5molO2和1molSO3达到平衡时放出的热量为Q3。下列关系正确的是
A.Q1=Q3=197kJ B.Q1=Q3<197kJ
C.Q1=2Q2 <197kJ D.Q2<Q1<197kJ
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)= Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
A.-218 kJ/mol B.-109 kJ/mol C.+218 kJ/mol D.+109 kJ/mol
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
下列说法正确的是
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)==BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
某一化学反应在不同条件下的能量变化曲线如右图所示。下列说法正确的是
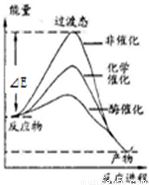
A.化学催化比酶催化的效果好
B.使用不同催化剂可以改变反应的热效应
C.使用不同催化剂可以改变反应的能耗
D.反应物的总能量低于生成物的总能量
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44kJ的热量。其它相关数据如下表,则表中X为:
| O=O(g) | H-H(g) | H-O(g) |
1mol化学键断裂时需要吸收的能量/kJ | 496 | X | 463 |
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N?N为154,则断裂1molN?H键所需的能量(kJ)是
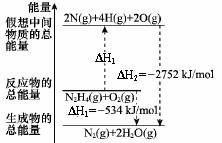
A.194 B.391 C.516 D.658
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
已知:HCN(aq)与NaOH(aq)反应的△H= -12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H = -55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A.-67.7 kJ /mol B.-43.5kJ /mol
C.+43.5 kJ/ mol D.+67.7 kJ/ mol
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
下列有关说法正确的是
A.放热反应在任何条件都能自发进行
B.应用盖斯定律,可计算某些难以直接测量的反应焓变
C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有② B.仅有②④ C.仅有②③④ D.全部符合要求
查看答案和解析>>
科目: 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:实验题
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO3)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验前,小组成员经讨论认定猜想丁不成立,理由是 。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
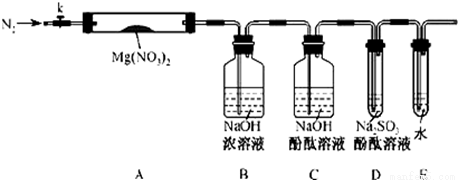
(2)实验过程
①取器连接后,放人固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E 中有气泡连续放出,表明 。
②称取Mg(NO3)2固体3.79 g置于A中,加热前通人N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 然后固定在管中固体部位下加热。
③观察到A 中有红棕色气体出现,C、D 中未见明显变化。
④待样品完全分解,A 装置冷却至室温、称量,测得剩余固体的质量为1.0g⑤ 取少量剩余固体于试管中,加人适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想 是正确的。
②根据D 中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应: (填写化学方程式),溶液颜色会退去;小组讨论认定分解产物中有O2存在,未检侧到的原因是 。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装里进一步研究。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com