
科目: 来源:2014高考名师推荐化学--预测4 题型:选择题
下列说法正确的是
A.1L 1mol?L-1的NH4Cl溶液中一定含有NA个NH4+
B.常温常压下,22.4L乙烯中含共价键数为5 NA
C.6.8g熔融的KHSO4中含有0.05 NA个阳离子
D.1mol冰醋酸和lmo1乙醇在浓硫酸加热下反应可生成NA个H2O
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:选择题
对①乙醇②淀粉③油脂④蛋白质的说法,不正确的是
A.等质量的②和③在人体内充分消化吸收时,③释放的能量更大
B.①能使④失去生理活性而变性
C.①可由②水解的最终产物反应制得
D.③和④在人体内的最终代谢产物相同
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:填空题
合成口服抗菌药琥乙红霉素片的原料G、某种广泛应用于电子领域的高分子化合物I的合成路线如下:
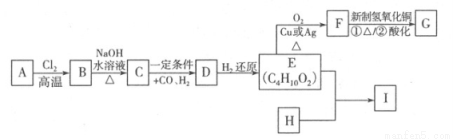
已知:① R—CH2—CH=CH2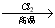 R—CHCl—CH=CH2
R—CHCl—CH=CH2
②R—CH2—CH=CH2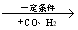 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)C的结构简式是 ,E中的官能团的名称是 。
(2)写出A B的反应方程式 ,该反应类型是 。
B的反应方程式 ,该反应类型是 。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,试写出E+H I的反应方程式 。
I的反应方程式 。
(4)关于G的说法中错误的是 (填序号)。
a.1 mol G最多可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G最多可与2 mol H2发生加成反应
d.1 mol G在一定条件下可与2 mol乙醇发生取代反应
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:简答题
已知:硫酸铜溶液中滴入氨基乙酸钠(H2 N—CH2—COONa)即可得到配合物A。其结构如右图:
N—CH2—COONa)即可得到配合物A。其结构如右图:
(1)Cu元素基态原子的外围电子排布式为  。
。
(2)1mol氨基乙酸钠中含有σ键的数目为 。
(3)氨基乙酸钠分解产物之一为二氧化碳,写出二氧化碳的一种等电子体 (写化学式)。已知二氧化碳在水中溶解度不大,却易溶于二硫化碳,请解释原因 。
(4)硫酸根离子的空间构型为 ;已知:硫酸铜灼烧可以生成一种红色晶体,其结构如右图,则该化合物的化学式是 。

查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:简答题
用菱锰矿(MnCO3)常含有Fe2O3、FeO、HgCO3·2HgO等杂质,工业常用菱锰矿制取锰,工艺流程如下:
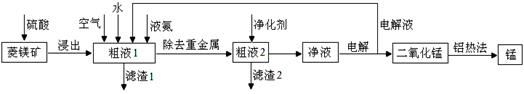
请回答下列问题:
(1)向粗液1中加入的水最后需要 方法才能达到技术要求。
(2)流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是  。
。
(3)净化剂主要成分为(NH4)2S,粗液2中发生主要反应的离子方程式为 。
(4)写出阳极的电极反应式 。说明电解液循环的原因 。
(5)写出铝热法炼锰的化学方程式 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:简答题
硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s) △H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s) △H=bkJ/mo l。
l。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是 。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为 ,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示 。
②滴加过程中,溶液中微粒浓度大小关系正确的是 (填字母)。
 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为
 (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:

① 写出反应器中发生反应的化学方程式是 。
② 电渗析装置如右图所示,写出阳极的电极反应式 。该装置中发生的总反应的化学
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:简答题
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下
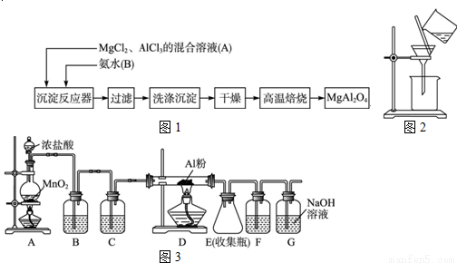
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如下图所示,过滤操作中的一处错误是 。
(3)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是 ,F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 ;
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:简答题
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为 。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是 (填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
弱酸 | HClO2 | HF | H2CO3 | H2S |
Ka/mol·L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为: (填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是 ;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为 。
(4)Ⅲ装置中生成气体a的电极反应式 ,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:简答题
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。

(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测5 题型:选择题
短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,各原子最外层电子数之和为10。A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数。则下列叙述正确的是
A.B元素处于元素周期表中第三周期ⅥA族
B.四种元素的原子半径:A<B<C<D
C.B、D的最高价氧化物具有相似的物理性质和化学性质
D.一定条件下,B单质能置换出D单质,C单质能置换出A单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com