
科目: 来源:2014高考名师推荐化学--预测3 题型:选择题
下列事实不能用金属活动性解释的是
A.生活中可用铝制的水壶烧水
B.镀锌铁制品破损后,镀层仍能保护铁制品
C .工业上常用热还原法冶炼铁,用电解法冶炼钠
.工业上常用热还原法冶炼铁,用电解法冶炼钠
D.电解法精炼铜时,其含有的Ag、Au杂质沉积在电解槽的底部
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测3 题型:填空题
草酸具莽有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体.莽草酸可以实现下列转化: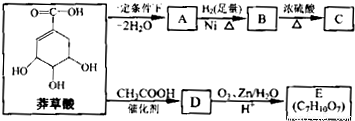
已知:①
请回答下列问题;
(1)A的结构简式是 ;
(2)B→C的化学方程式是 ,反应类型是 ;
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原子.E分子中手性碳原子有 个;
(4)莽草酸经过中间产物D合成E的目的是 ;
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测3 题型:填空题
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为 。
(2)N、P、As原子的第一电离能由大到小的顺序为 。
(3)NH3的沸点比PH3 高,原因是 ;PO43-离子的立体构型为 。
高,原因是 ;PO43-离子的立体构型为 。
(4)PH3分子中P原子采用 杂化。
(5)H3AsO4和H3A sO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
sO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6) CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测3 题型:简答题
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下: 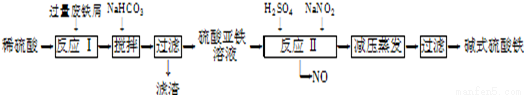
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 ;加入少量NaHCO3的目的是调节pH,使溶液中的
(填“Fe3+”“Fe2+”或“Al3+”)沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 ,若参与反应的O2有11.2L(标准状况),则相当(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成
Fe2(OH)42+ 聚合离子.该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-,为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填字母)。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测3 题型:计算题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备Mg(OH)2的工艺流程如下图所示。
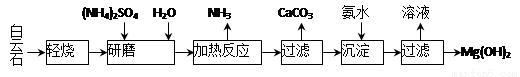
(1)研磨的作用是 。
(2)该工艺中可循环使用的物质是 、 (写化学式)。
(3)白云石轻烧的主要产物是MgO·CaCO3,而传统工艺是将白云石加热分解为MgO和CaO后提取,白云石轻烧的优点是 。
(4)加热反应的离子方程式为 。
(5)①加热反应时,在323k和353k溶液中c(NH4+)与反应时间的关系如下图所示,请在下图画出373k的曲线。
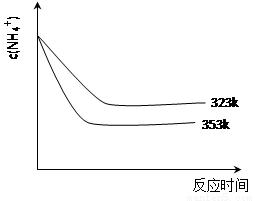
②由图可知,随着温度升高: 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测3 题型:简答题
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
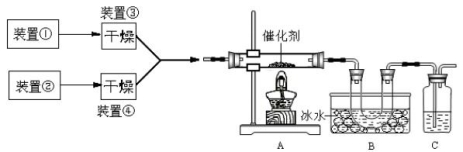
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验
证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生
反应的化学方程式是 。B处冰水冷却的U型管中有红棕色气
体生成且越接近U型管底部颜色越浅,请解释原因 。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中
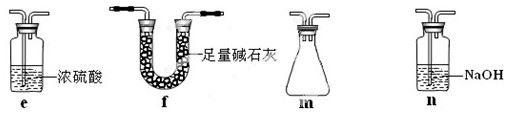
若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是 (生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进 (从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制
NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
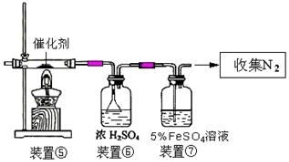
请回答:装置⑦的作用可能是 ;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测3 题型:简答题
乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO
和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是 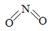 和
和 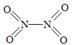 。
。
物质 | NO2 | N2O4 | |
化学键 | N=O | N—N | N=O |
键能(kJ/mol) | 466 | 167 | 438 |
写出NO2转化N2O4的热化学方程式 。
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式 。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
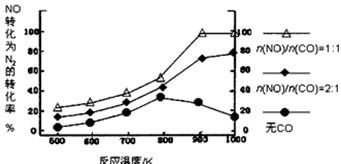
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为 、 ;该反应的?H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO 发生反应的化学方程式为 。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测3 题型:简答题
沈阳理工大学在废旧电池回收处理现状研究报告中报道了一种湿法处理方法,以下是对废旧电池材料(含有Ni(OH)2、碳粉、氧化铁和铝箔等)进行资源回收所设计的实验流程

已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O
③金属离子在该实验流程下完全沉淀的pH:
离子 | Al3+ | Fe3+ | Ni2+ |
pH | 5.2 | 4.1 | 9.7 |
回答下列问题:
(1)物质A 的作用是调节溶液的pH以除去杂质Fe3+和Al3+,以下最适合作为A物质的是________。
A.NiO B.盐酸 C.NaOH D.氨水
(2)滤渣②的主要成分是_________________________________。
(3)写出加入Na2C2O4 溶液反应的化学方程式: _____________。
(4)写出电解滤液③的阴极反应式___________________________。
检验电解滤液③时阳极产生的气体的方法是用湿润的________试纸检验。
(5)由沉淀A生成Ni(OH)3的过程是先在滤渣③中加入过量NaOH溶液进行沉淀转化,待反应完全后再通入电解滤液③产生的气体进行氧化,请写出该氧化过程的离子方程式:__________________。
(6)如何检验Ni(OH)3是否洗涤干净?
________________________________。
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:选择题
北京时间2012年9月14日,国外媒体报道,美国宇航局的“好奇”号火星车已经展开它的X射线分析器,并首次完成对火星物质元素成分的分析。下面这张图显示的是α粒子与X射线分光仪从某仪器获得的元素分析数据。多个峰值表明各种成分非常丰富,其中包括在火星大气里发现的氩,该仪器自身的铝,以及火星土壤微粒所含的硫黄和氯.
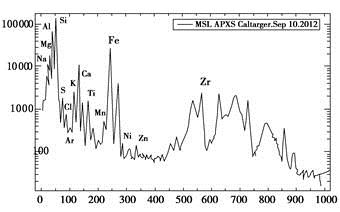
理解此图,判断下列说法错误的是
A.峰值最高的过渡元素在周期表中的位置是第四周期第Ⅷ副族
B.上述元素分析图中,同一周期的两种主族元素可形成1∶1型离子化合物只有一种,其电子式为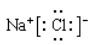
C .氯比硫的非金属性强的依据之一是HCl比H2S稳定
D.工业上常用电解氧化铝的方法制备铝
查看答案和解析>>
科目: 来源:2014高考名师推荐化学--预测4 题型:选择题
一氧化碳是一种用途相当广泛的化工基础原料。利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。 Ni(s)+4CO(g) Ni(CO)4(g)
Ni(CO)4(g)
在一密闭容器中,放入镍粉并充入一定量的CO气体,已知该反应的平衡常数如下表
温度℃ | 25 | 80 | 230 |
平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
下列说法正确的是
A.上述反应是熵增反应
B.在80℃时,测得某时刻,Ni(CO)4 、CO浓度均为0.5 mol·L-1,则此时v(正)<v(逆)
C.25℃时,反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数是0.5
Ni(s)+4CO(g)的平衡常数是0.5
D.恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com