
科目: 来源:2014年高考化学鲁科版4.3铜及其化合物 金属材料与复合材料练习卷(解析版) 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
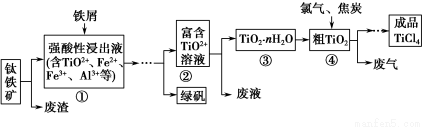
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3++Fe=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在 范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+??Fe3++3H2O的平衡常数K= 。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用 方法。
| TiCl4 | SiCl4 |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目: 来源:2014年高考化学鲁科版复习专练1气体定量测定在实验中应用练习卷(解析版) 题型:实验题
某实验小组利用反应2CuO+2Cl2 2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
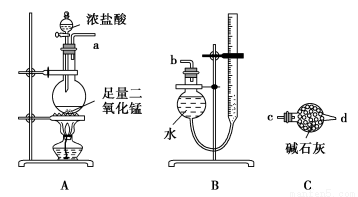
方案一:通过测定反应物CuO的质量m(CuO)和产物O2的体积V(O2)来测定铜的近似相对原子质量。
(1)按气流方向从左到右用胶管(图中未画出)将选择的仪器组合成一套实验装置,连接顺序为a→( )( )→( )( )→( )( )→( )( )→b。
(2)装置B是由干燥管和碱式滴定管改造而成的测量气体体积的装置,实验前滴定管液面初读数为V1 L,实验后恢复到室温,调节装置两侧液面相平后得到末读数为V2 L,设室温时气体摩尔体积为Vm L·mol-1,且E装置中CuO的质量为m1 g,充分反应后生成CuCl2的质量为m2 g,则铜的近似相对原子质量的表达式为
[用含m1、V1、V2的代数式表示]。
(3)若氧化铜中混有铜,则测定结果 (填“偏大”、“偏小”或“无影响”)。
(4)装置E在实验过程中的主要现象是 。
方案二:利用A、D、E、F四套装置(尾气由其他的装置处理)完成测定任务。
(5)你认为测定的物理量有 (写出一组),按你测定的物理量,写出铜的近似相对原子质量的表达式: 。
查看答案和解析>>
科目: 来源:2014年高考化学鲁科版复习专练1气体定量测定在实验中应用练习卷(解析版) 题型:实验题
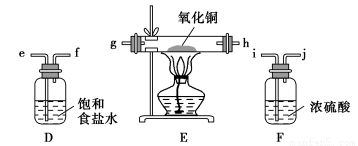
某同学利用氯酸钾分解制氧气的反应,测定氧气的摩尔质量,实验步骤如下:
①把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量,质量为a g。
②装好实验装置。
③检查装置气密性。
④加热,开始反应,直到产生一定量的气体。
⑤停止加热(如图所示,导管出口高于液面)。
⑥测量收集到的气体的体积。
⑦准确称量试管和残留物的质量为b g。
⑧测量实验室的温度。
⑨把残留物倒入指定的容器中,洗净仪器,放回原处,把实验桌面收拾干净。
⑩处理实验数据,求出氧气的摩尔质量。
回答下列问题:
(1)如何检查装置的气密性? 。
(2)以下是测量收集到的气体体积必须包括的几个步骤:
①调整量筒内外液面高度使之相同;②使试管和量筒内的气体都冷却至室温;③读取量筒内气体的体积。这三步操作的正确顺序是 (请填写步骤代号)。
(3)测量收集到的气体体积时,如何使量筒内外液面的高度相同? 。
(4)如果实验中得到的氧气体积是c L(已换算为标准状况),水蒸气的影响忽略不计,氧气的摩尔质量的计算式为(含a、b、c,不必化简)M(O2)= 。
查看答案和解析>>
科目: 来源:2014年高考化学鲁科版复习专练1气体定量测定在实验中应用练习卷(解析版) 题型:实验题
某课外兴趣小组为探究某种合金(含Mg、Al)中铝的含量,设计如图装置进行实验。
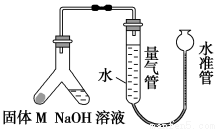
(1)如何检查该装置的气密性? 。
(2)写出该合金与氢氧化钠溶液反应的离子方程式: 。
(3)使足量氢氧化钠溶液与a g合金(固体M)充分反应,进入量气管的气体体积为V mL(已换算成标准状况,下同)。若a=0.036,V=22.4,该合金中铝的质量分数是 。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,与a g合金粉末充分反应,则进入量气管内的气体体积 (填“>”、“<”或“=”)V mL;利用测得的气体体积能否对合金中的Al含量进行计算? (填“能”或“否”)。
查看答案和解析>>
科目: 来源:2014年高考化学鲁科版复习专练1气体定量测定在实验中应用练习卷(解析版) 题型:实验题
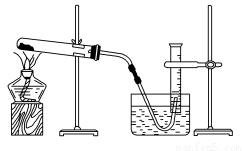
饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。某兴趣小组进行了如下实验探究。
实验一:定性研究。
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水(如图所示),充分反应,有少量气泡产生,溶液浅黄绿色退去;
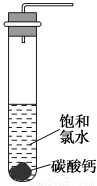
②过滤,将滤液滴在有色布条上,发现滤液比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
第三份滤液加热,看到滤液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2。
请回答:
(1)反应后所得的溶液漂白性比氯水强的原因是 。
(2)依据上述实验可推知:滤液中的溶质除CaCl2、HClO外,还有 (填写溶质的化学式)。
实验二:定量研究。
在圆底烧瓶底部,用一塑料网包住块状石灰石(过量)与150 mL饱和氯水反应,按下图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,将装置密封后再加热,煮沸烧瓶中的液体,量筒中的气体不再增加时停止实验。
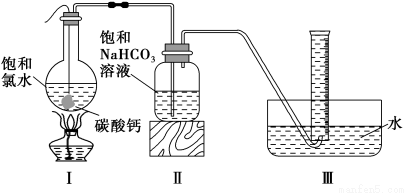
请回答:
(3)实验结束后检测到量筒中收集到的气体除CO2外还有O2,请写出Ⅰ中产生O2的化学反应方程式 。
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,请你对装置Ⅲ进行改进(水槽中仍为水),最简单的方法是 。
查看答案和解析>>
科目: 来源:2014年高考化学鲁科版复习专练1气体定量测定在实验中应用练习卷(解析版) 题型:实验题
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,
通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
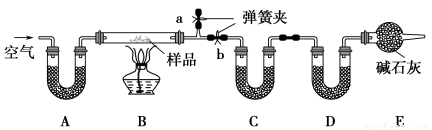
(1)加热前通入空气的目的是 ,
操作方法为 。
(2)装置A、C、D中盛放的试剂分别为:A ,
C ,D 。
(3)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl的含量将 (填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中NaHCO3的含量将 ;若撤去E装置,则测得Na2CO3·10H2O的含量将 。
(4)若样品质量为w g,反应后C、D增加的质量分别为m1 g、m2 g,由此可知混合物中NaHCO3的质量分数为 (用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目: 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A.8 g甲烷含有的共价键数约为NA
B.常温常压下,22.4 L二氧化碳原子总数为3NA
C.1 mol Fe与稀HNO3反应,一定转移3 NA个电子
D.1mol单质硅含有2molSi-Si键
查看答案和解析>>
科目: 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.使苯酚显紫色的溶液:NH4+、K+、SCN-、NO3-
B.0.1mol·L-1HNO3溶液: Na+、Mg2+、SO42-、Cl-
C.0.5mol·L-1FeCl3溶液:K+、Na+、I-、SO42-
D.由水电离产生的c(H+)=10-13 mol·L-1的溶液:K+、Na+、Cl-、HCO3-
查看答案和解析>>
科目: 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
下列溶液中能够区别SO2和CO2气体的是
①澄清石灰水 ②KMnO4酸性溶液 ③氯水 ④品红溶液
A.①③④ B.②③④ C.①②③ D.全部
查看答案和解析>>
科目: 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
勤洗手和经常对环境进行消毒是预防传染病的有效途径。2012年4月,H7N9疫情爆发,可以用某种消毒液进行消毒,预防传染。已知该消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是
A.KMnO4 B.H2O2 C.NaClO D.NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com