
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A.生成40.0LN2(标准状况) B.有0.250molKNO3被氧化
C.转移电子的物质的量为2.5mol D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且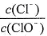 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是( )
A.若某温度下,反应后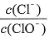 =11,则溶液中
=11,则溶液中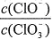 =
=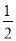
B.参加反应的氯气的物质的量等于0.5amol
C.改变温度,反应中转移电子的物质的量ne的范围: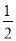 amol≤ne≤
amol≤ne≤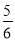 amol
amol
D.改变温度,产物中KC1O3的最大理论产量为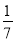 amol
amol
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
如图是氯化铯晶体的晶胞,已知晶体中2个最近的Cl- 离子核间距为a cm,氯化铯的摩尔质量为M g/mol,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
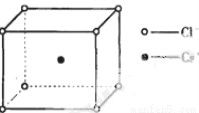
A.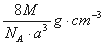 B.
B.
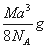
C. 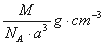 D.
D. 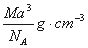
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
(5分)在HF、H2O、NH3、CH4、CO32-、CO2、HI分子中
(1)CO32-的价层电子对的空间构型为
(2)以极性键相结合,具有正四面体结构的非极性分子是 。
(3)以极性键相结合,具有三角锥型结构的极性分子是 。
(4)以极性键相结合,具有V型结构的极性分子是 。
(5)以极性键相结合,而且分子极性最大的是 。
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
(6分)完成下列反应的离子方程式:
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42—恰好完全沉淀:
(2)向明矾溶液中逐滴加入Ba(OH) 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时:
(3)向Ca(HCO3) 2溶液中加入过量的NaOH溶液:
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
(8分)二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式
(2)已知:Se+2H2SO4(浓) = 2SO2↑+SeO2+2H2O 2SO2+SeO2+2H2O = Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O ②I2+2Na2S2O3 = Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
(6分)用9mol/L的浓硫酸稀释成 0.9mol/L的稀硫酸 100mL ,回答下列问题:
(1)配制操作可分解成如下几步,以下正确的操作顺序是_____________________
A 向容量瓶中注入少量蒸馏水,检查是否漏水
B 用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C 用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D 根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀
G.用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2 cm
(2)如果实验室用98%的浓硫酸(密度为1.8g·cm-3 ) 配制3. 6 mol·L-1的稀硫酸250mL。计算所需浓硫酸的体积为_____________mL。
(3)由于错误操作, 使得到的浓度数据比正确的偏大的是___________(填写序号)。
A 使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B 没有用蒸馏水洗烧杯2-3次,并将洗液移入容量瓶中
C 容量瓶用蒸馏水洗净,没有烘干
D 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
E.把配好的溶液倒入用蒸馏水洗净而未干的试剂瓶中备用
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
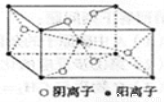
(6分)X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是 。
(2)R2+的水合离子中,提供孤电子对的原子是 。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数比是 。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是 。
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,
具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们
的晶体结构如图所示。
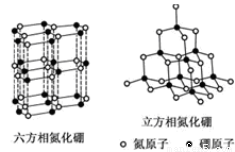
(1)关于这两种晶体的说法,正确的是 (填序号)。
A.立方相氮化硼含有σ键和π键,所以硬度大
B.六方相氮化硼层间作用力小,所以质地软
C.两种晶体中B-N键均为共价键
D.两种晶体均为分子晶体
(2)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为 ,其结构与石墨相似却不导电,原因是 。
(3)立方相氮化硼晶体,硼原子的杂化轨道类型为 。该晶体的天然矿物在青藏高原地下约300 km在古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是 。
(4)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 molNH4BF4含有 mol配位键。
查看答案和解析>>
科目: 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
(8分)将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:
KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O
(2)上式反应中的还原剂是 ,当还原剂失去1mol电子时,氧化产物的物质的量为 。
(3)a +b的最大值为 ,a +b最小值为 。
(4)当 a +b =0.18时,残留固体的质量为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com