
科目: 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
A、B、C、D均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则A不可能是

A.金属单质 B.非金属单质 C.两性氧化物 D.碱
查看答案和解析>>
科目: 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
W、X、Y、Z四种短周期元素。已知X原子的核外电子数和Ne原子相差1,在同周期中X原子半径最大,W、Y、Z在周期表中的相对位置如图,Z的非金属性在同周期元素中最强。下列说法不正确的是

A.简单离子半径:Y>X
B.最高价氧化物对应水化物的酸性:Z>Y
C.W与X形成的化合物属于离子化合物
D.W、X、Z只能形成一种化合物
查看答案和解析>>
科目: 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
常温下,取pH=2的 HA溶液与HB溶液各1 mL,分别加水稀释,测得pH变化与稀释倍数关系如图所示。下列叙述正确的是
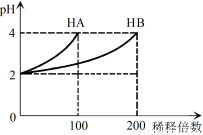
A.HB的电离方程式为HB=H++B-
B.稀释前,c(HB) > c(HA)=0.01 mol·L-1
C.NaA的水溶液中,离子浓度大小为c(Na+)>c(A-)>c(OH-)>c(H+)
D.NaA、NaB的混合溶液中:2c(Na+)=c(A-)+c(B-)+c(HB)
查看答案和解析>>
科目: 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:简答题
(16分)NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下: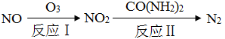
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。
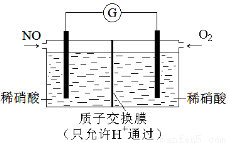
查看答案和解析>>
科目: 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:简答题
(15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
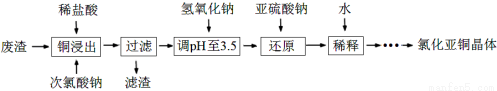
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ [CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
查看答案和解析>>
科目: 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:实验题
(14分)某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ 制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1 硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是
(用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ 实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置。改进装置如图(夹持和加热装置略去)。
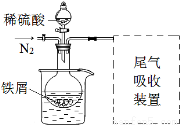
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
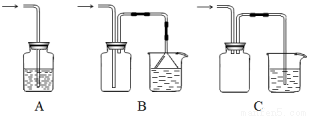
(5)下列装置适合尾气吸收的是 (填序号)。
Ⅲ 晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000 g置于锥形瓶中,加入10 mL 3 mol·L-1硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000 mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
查看答案和解析>>
科目: 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:填空题
[化学——物质结构与性质](13分)
氢能是一种洁净的可再生能源,制备和储存氢气是氢能开发的两个关键环节。
Ⅰ 氢气的制取
(1)水是制取氢气的常见原料,下列说法正确的是 (填序号)。
A.H3O+的空间构型为三角锥形
B.水的沸点比硫化氢高
C.冰晶体中,1 mol水分子可形成4 mol氢键
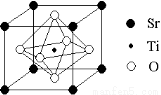
(2)科研人员研究出以钛酸锶为电极的光化学电池,用紫外线照射钛酸锶电极,使水分解产生氢气。已知钛酸锶晶胞结构如图,则其化学式为 。
Ⅱ 氢气的存储
(3)Ti(BH4)2是一种储氢材料。
①Ti原子在基态时的核外电子排布式是 。
②Ti(BH4)2可由TiCl4和LiBH4反应制得,TiCl4 熔点-25.0℃,沸点136.94℃,常温下是无色液体,则TiCl4晶体类型为 。
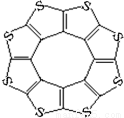
(4)最近尼赫鲁先进科学研究中心借助ADF软件对一种新型环烯类储氢材料(C16S8)进行研究,从理论角度证明这种分子中的原子都处于同一平面上(结构如图所示),每个平面上下两侧最多可储存10个H2分子。
①元素电负性大小关系是:C S(填“>”、“=”或“<”)。
②分子中C原子的杂化轨道类型为 。
③有关键长数据如下:
| C—S | C=S | C16S8中碳硫键 |
键长/pm | 181 | 155 | 176 |
从表中数据可以看出,C16S8中碳硫键键长介于C—S与C=S之间,原因可能是: 。
④C16S8与H2微粒间的作用力是 。
查看答案和解析>>
科目: 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:推断题
[化学——有机化学基础](13分)
香豆素是一种重要香料,以下是两种常见香豆素。
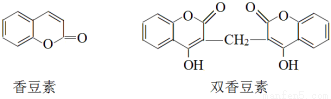
(1)关于香豆素和双香豆素,下列说法正确的是 (填序号)。
A.分子中均含有酯基
B.都属于芳香族化合物
C.双香豆素不能使溴水褪色
D.1 mol香豆素含C=C数为4NA(NA为阿伏加德罗常数的值)
(2)写出香豆素与足量NaOH溶液反应的化学方程式 。
(3)以甲苯为原料生产香豆素流程如下:

已知:(ⅰ)B可与FeCl3溶液发生显色反应;
(ⅱ)同一个碳原子上连两个羟基通常不稳定,易脱水形成羰基。
①C的结构简式是 。
②B→C的反应类型是 。
③ 与乙酸酐(
与乙酸酐(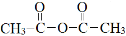 )反应,除生成
)反应,除生成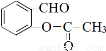 外,另一种产物是 。
外,另一种产物是 。
④异香豆素与香豆素互为同分异构体,具有以下特点:(a)含有苯环;(b)含有与香豆素相似的两个六元环;(c)1 mol异香豆素与足量NaOH溶液反应时消耗1 mol NaOH。写出异香豆素的结构简式 。
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知:2H2(g)+O2(g)=2H2O(g);ΔH=-270kJ·mol-1,下列说法错误的是
A.2mol水蒸气分解成2mol氢气与1mol氧气吸收270kJ热量
B.2mol氢气与1mol氧气反应生成2mol液态水放出热量大于270kJ
C.在相同条件下,2mol氢气与1mol氧气的能量总和大于2mol水蒸汽的能量
D.2个氢气分子与1个氧气分子反应生成2个水蒸汽分子放出270kJ热量
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+1/2O2(g)===CO2 (g);△H=-283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com