
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的:①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3固体 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
关于反应K35ClO3+6H37Cl=KCl+3Cl2↑+3H2O的有关叙述中,正确的是
A. KCl中含有35Cl
B. 生成物Cl2的相对分子质量为73.3
C.该反应转移的电子数为6e-
D.氧化剂和还原剂的物质的量之比为1:6
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下图所示原电池工作时,右池中Y2O72-转化为Y3+。下列叙述正确的是
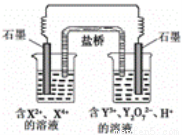
A.左池电极反应式:X4+ + 2e-=X2+
B.每消耗1mol Y2O72-,转移3mol电子
C.改变右池溶液的c(H+),电流强度不变
D.左池中阴离子数目增加
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)有等体积、等pH的Ba(OH)2和NH3·H2O两种溶液,用等浓度的盐酸来滴定,恰好中和时,用去酸的体积分别为V1、V2,则有:V1 V2(填“>”、“<”或“=”)
(2)常温下,等体积、等pH的醋酸和硫酸溶液中:c(CH3COO-) c(SO 42-) 填
(填“>”、“<”或“=”)
(3)在AgCl悬浊液中加入过量KI溶液,白色沉淀转化为黄色沉淀。加入过量KI溶液充分反应后,溶液中Ksp(AgCl) (填“增大”、“减小”或“不变”)
(4)在0.10mol·L-1 氨水中,加入少量NH4Cl晶体后,则 NH3·H2O的电离程度 (填“增大”、“减小”或“不变”)
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(3分)科学家一直致力于“人工固氮” 的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个1L的密闭容器中充入2molN2和6molH2,反应达平衡时生成NH3的浓度为1 mol·L-1,并放出Q kJ热量,该反应的热化学方程式可表示为 ____ __。
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
已知:N2O4(g)  2NO2(g) ΔH=+57.20kJ · mol-1
2NO2(g) ΔH=+57.20kJ · mol-1
在100℃时,将0.100molN2O4气体充入1L恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
c(N2O4) /mol··L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
c(NO2) /mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
(1) 该反应的平衡常数表达式为 ______;从表中数据分析:
c1 c2 (填“>” 、“<” 或“=” )。
(2)下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B.NO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗n mol N2O4的同时生成2n mol NO2
E.反应体系中NO2、N2O4的体积比为1:2
(3)若起始时充入NO2气体0.200mol,则达到平衡时NO2气体的转化率为a;其它条件不变时,下列措施能提高NO2转化率的是 (填字母)。
A.降低温度
B.减小NO2的浓度
C.升高温度
D.增加NO2的浓度
E.再充入一定量的He
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)AgNO3的水溶液呈酸性的原因是(用离子方程式表示): ;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,充分反应后溶液呈中性,则反应后溶液存在的离子有 ,其浓度由大到小的顺序为 ,氨水的浓度a 0.01 mol·L-1(填“>”、“ <”或“=”)。
(3)用已知浓度的NaOH标准溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是
A.未用标准液润洗碱式滴定管;
B.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液;
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗;
D.滴定终点读数时,俯视滴定管的刻度,其它操作均正确;
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)将该温度下a mL pH=13 NaOH溶液与b mL0.05mol/L H2SO4混合,所得混合溶液的pH=7,
则a:b =
(2)若在含有足量AgCl固体的饱和AgCl溶液中分别放入:
A、100mL蒸馏水中; B、100mL 0.2 mol·L-1AgNO3溶液中;
C、100 mL 0.1 mol·L-1AlCl3溶液中; D、100mL 0.1 mol·L-1盐酸溶液中。
充分搅拌后,银离子浓度最小的是 (填序号)
(3)在25℃下,向浓度均为0.20 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 ;当测得溶液pH=11.00时,则此温度下残留在溶液中的c(Mg2+):c(Cu2+)=
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.0×10-20)
查看答案和解析>>
科目: 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
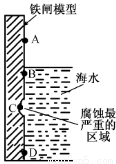
①该电化腐蚀称为 。
②图中A和B区域相比较,腐蚀较慢的是 (填字母)。
(2)实验室经常用到FeCl3溶液,在配制FeCl3溶液时常需加入少量 的 ;将FeCl3溶液和碳酸氢钠溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(3)已知t℃时,反应FeO(s)+CO(g) Fe( s) +CO2(g)的平衡常数K= 0.25。
Fe( s) +CO2(g)的平衡常数K= 0.25。
①t℃时,反应达到平衡时n(CO2):n(CO)=
②若在1L密闭容器中加人0.02 mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时
FeO(s)转化率为50%,则x= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com