
科目: 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Na+、Fe2+、NO3-、SO42-
B.滴入酚酞试液显红色的溶液中:K+、Fe3+、ClO-、SO42-
C.c(H+)/c(OH-)=1×1012的溶液中:NH4-、Cl-、NO3-、Al3+
D.由水电离出的c(H+)=1×10-12mol/L的溶液中:Na+、K+、Cl-、HCO3-
查看答案和解析>>
科目: 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.加入KSCN溶液一定不变红色 B.溶液中一定含Cu2+
C.溶液中一定含Fe2+ D.剩余固体中一定含铜
查看答案和解析>>
科目: 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是
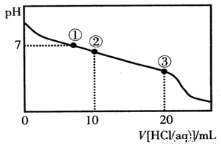
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目: 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(8分)选择以下物质填写下列空白:
A.氢氧化钠 B.氧化镁 C.He D.二氧化硅
E.氯化铵 F.碘晶体 G.二氧化硫 H.钾
(1)晶体中存在分子的是 。(2)晶体中既有离子键又有共价键的是 。
(3)融化时需要破坏共价键的是 。(4)最易溶于水的分子晶体是 。
查看答案和解析>>
科目: 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(13分)C和Si分别是构成生命体和岩石的重要元素。
(1)CH4和SiH4沸点较高的是 。原因是 。稳定性较高的是 。
(2)SiC的晶体结构与晶体硅相似,其中C原子的杂化方式为 。微粒间存在的作用力是 。
(3)CO2形成的干冰晶体与SiO2晶体相比,下列说法不正确的有 。
A中心原子的杂化方式不同 B构成晶体的微粒种类不同 C晶体内微粒间作用力不同
D晶体导电性不同 E.常温时,晶体挥发性不同
(4)已知键能数据如下,化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。写出Si(s)在O2中燃烧生成SiO2(s)的热化学方程式 。
化学键 | Si—O | O=O | Si—Si |
键能(kJ·mol-1) | 460 | 498 | 226 |
(5)氨基酸是构成蛋白质的物质基础,甘氨酸H2N-CH2-COOH中,各元素的电负性从大到小为 。
查看答案和解析>>
科目: 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(8分)A、B、C、D、E、F为原子序数依次增大的短周期元素,B、C相邻且同周期,A、D同主族。C原子最外层电子数是核外电子层数的3倍,A、C能形成两种化合物甲和乙,原子个数比分别为2∶1和1∶1,甲为常见的溶剂。E是地壳中含量最多的金属元素;F元素为同周期电负性最大的元素。D和F可形成化合物丙,E和F可形成化合物丁。G为第四周期未成对电子数最多的元素。请回答下列问题:
(1)写出G基态原子的价电子排布式 。
(2) B和C比较,第一电离能较大的是 (填元素符号),其原因为 。
(3)甲、乙两分子的中心原子的杂化类型是否相同 (相同、不相同)。
(4)已知化合物丁熔点190℃,沸点183℃。丙和丁比较,熔点较高的是 (填化学式),
(5)配合物戊由G3+与甲、元素F构成,已知该配合物的配位数为6。在含有0.1mol戊的溶液中加入AgNO3溶液至过量,经过滤、洗涤、干燥后,得到28.7g白色沉淀。,则戊的化学式为 。
查看答案和解析>>
科目: 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(16分)等电子原理的基本观点是:原子数相同且价电子总数相等的分子或离子具有相同的化学键类型和空间构型,互称为等电子体。等电子体的结构相似,物理性质相近。如:N2、CO与C22-、CN-为等电子体。
(1)已知CaC2为离子化合物,则CaC2的电子式为 。
(2)聚丙烯腈俗称人造羊毛,由丙烯腈分子CH2=CH—CN经聚合反应生成;则CH2=CH—CN中C原子的杂化方式为 ;分子中σ键和π键数之比为 。
(3)CO常与过渡金属原子M形成配合物M(CO)n ,其中满足中心原子价电子数与配位体提供电子总数之和为18,若M为Fe,则n= 。
(4)CO与N2的结构相似,分子中含有共价三键,可表示为C≡O ;下表是两者的键能数据(单位:kJ·mol-1)
| C-O | C=O | C≡O |
CO | 357.7 | 798.9 | 1071.9 |
| N-N | N=N | N≡N |
N2 | 154.8 | 418.4 | 941.7 |
CO与N2中化学性质较活泼的是 ;结合数据说明原因 。
(5)Fe3+,Fe2+,Co3+,Co2+都能与CN- 形成配合物。硫酸亚铁溶液中加入过量KCN溶液,可析出黄色晶体K4[Fe(CN)6];若在上述溶液中再通入氯气后,可析出深红色晶体K3[Fe(CN)6];在K4[Fe(CN)6]和K3[Fe(CN)6]晶体中都不存在的微粒间作用力是 。(填标号)
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
(6)写出与NO3- 互为等电子体的分子 (写出一种)。
查看答案和解析>>
科目: 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:填空题
(7分)决定物质性质的重要因素是物质结构。请回答下列问题:
(1)铜是过渡元素。化合物中,铜常呈现+1价或+2价。右图为某铜氧化物晶体结构单元,该氧化物的化学式为 。
(2)第三周期部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/K | 1266 | 1534 | 183 |
解释MgF2与SiF4熔点差异的原因 。
(3)A和B为第三周期元素,其原子的部分电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
则A的电负性 B的电负性(填“>”、“<”或“=”)。
(4)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5、CrO2、Fe3O4中,更适合作录音带磁粉原料的是__________(填化学式)。
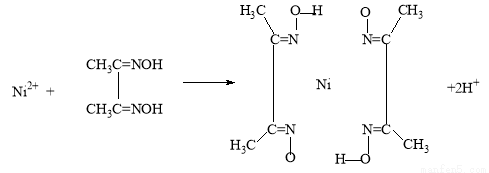
(5)实验室检验Ni2+可用丁二酮肟与之作用生成腥红色配合物沉淀。
②在配合物中用化学键和氢键标出未画出的作用力(镍的配位数为4)。
查看答案和解析>>
科目: 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:选择题
北京2008奥运会金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)。为了验证他们的猜想,请你选择一种试剂证明甲、乙、丙猜想的正误
A.硫酸铜溶液 B.盐酸 C. 稀硝酸 D. 硝酸银溶液
查看答案和解析>>
科目: 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:选择题
下列数据是对应物质的熔点据此做出的下列判断中错误的是
Na2O | NaCl | AlF3 | AlCl3 |
920 | 801 | 1291 | 190 |
BCl3 | Al2O3 | CO2 | SiO2 |
-107 | 2073 | -57 | 1723 |
A.铝的化合物的晶体中有的是离子晶体
B.表中只有BCl3和干冰是分子晶体
C.同族元素的氧化物可形成不同类型的晶体
D.不同族元素的氧化物可形成相同类型的晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com