
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
已知H2A为弱酸,下列说法错误的是
A.0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+ c(H2A)= 0.1mol/L
B.常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5
C.常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性
D.常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
某有机物的结构简式如下图所示,则下列有关说法正确的是
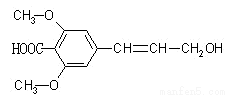
A.该有机物可以发生氧化、加成、加聚、取代等反应
B.该有机物能与NaOH溶液反应,则1mol该有机物能消耗2molNaOH
C.该有机物的分子式为C12H14O5,且与C11H12O5 一定互为同系物
D.该有机物分子中所有碳原子不可能都在同一平面上
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
已知氧化性:HClO>Cl2>Fe3+>SO42-;常温下,电离常数:K(H2CO3)>K(HClO)>K(HCO3-)>KAl(OH)3;则下列相关离子方程式正确的是
A.0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+ClO-=SO42-+Cl-+H+
B.小苏打溶液与偏铝酸钠溶液混合:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
C.“84”消毒液(主要成分为NaClO)露置在空气中变质:2ClO-+CO2+H2O=CO32-+2HClO
D.在“84”消毒液中滴加FeSO4溶液:2Fe2++ClO-+H2O=2Fe3++Cl-+2OH-
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
J、Q、M、R、T是原子序数依次增大的短周期主族元素,J、Q、R在周期表中的相对位置如下表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。下列说法正确的是
J |
| Q |
|
| R |
A. J和氢元素形成的化合物分子中只含极性共价键
B. R、Q两元素形成的氢化物中,R的氢化物沸点更高
C. J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是H2RO4
D. M单质能与氢氧化钠溶液反应,其中水和氢氧化钠都是氧化剂
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
(15分)
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。
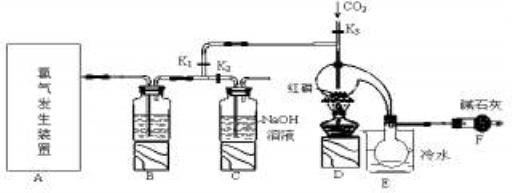
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
请回答:
(1)写出A中反应的离子方程式 。
(2)B装置中所盛试剂是 ;E中烧杯内冷水的作用是 。
(3)实验前玻璃管之间连接需要用到橡皮管,其连接方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管中。
(4)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。其中通入干燥CO2的目的是 。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过 (填实验名称)即可得到较纯净的PCl3。
(6)实验后关闭K1,打开K2,将A、B中余氯通入300ml 1mol/L的NaOH溶液中。若NaOH恰好完全反应,则吸收氯气的物质的量为(假设反应生成了NaCl 、 NaClO 和 NaClO3 等钠盐) mol,反应中转移电子的物质的量(n)的范围是 。
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
序号 | A | B | C | D |
目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
图示 |
|
|
|
|
(2)在5000C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO2和1molO2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO3的体积分数甲
乙。(填“>”“<”或“=” )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。

Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“=” )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)
Ⅰ.氯碱工业中常用离子交换膜法电解制碱(如图1所示)。

(1)写出图1中阴极的电极反应式 。
(2)已知阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。工业上若用图2装置电解饱和Na2SO4溶液来生产纯净的NaOH和H2SO4,则该装置最主要的缺陷是 。

Ⅱ.辉钼矿(MoS2)是一种重要的矿物。图3是辉钼矿多层焙烧炉的示意图,其中1,2,3,…是炉层编号。580,600,610,…是各炉层的温度(℃)。图4给出了各炉层固体物料的物质的量百分含量。
已知:MoS2焙烧生成1molMoO3的反应热△H1=-1011KJ/mol;MoO2氧化生成1molMoO3的反应热△H2=-154KJ/mol。试回答:
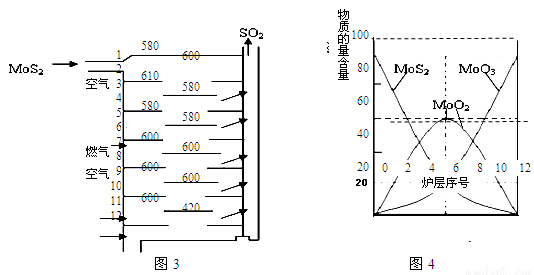
(1)验证辉钼矿焙烧生成的气体是SO2而不是SO3的方法是 。
(2)辉钼矿焙烧生成的气体能使硫酸酸化的KMnO4溶液褪色,用化学方程式表示褪色的原因 。
(3)第6炉层存在的固体物质分别是MoS2、MoO3、MoO2,则它们的物质的量之比为 。
(4)图4表明,中间炉层(4~6)可能存在一种“固体+固体→固体+…”的反应,请写出该反应的热化学反应方程式 。
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)【化学——选修2:化学与技术】
(一)硫酸厂常用煅烧黄铁矿(FeS2)来制取硫酸。
(1)煅烧黄铁矿的主要化学方程式为 。
(2)SO2和O2的反应为 2SO2(g)+O2(g) 2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
2SO3(g),该反应在体积不变的密闭容器中进行,则下列 (填序号)可作为反应达到平衡的判断依据。
A.v正(SO2)=v正(SO3)
B.各组分的体积分数不再变化
C.反应体系的温度不再变化
D.混合气体的平均相对分子质量不再变化
E.混合气体的密度不再变化
(3)热交换器是实现冷热交换的装置,化学实验中也经常利用热交换来实现某种实验目的。试分析气、液热交换时通常使用的仪器是________________________。(写名称)
(4)硫酸工业所产生的尾气除了含有N2、O2外,还含有SO2,微量的SO3和酸雾。能用于测定硫酸尾气中SO2含量的试剂是___________________。(填序号)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞试液 D.碘水、淀粉溶液
(二)实验室常用硫酸厂的烧渣(主要成分是Fe2O3及少量FeS、SiO2)来制备绿矾(FeSO4·7H2O)。
其中测定绿矾产品中FeSO4·7H2O含量的实验步骤为:
a.称取5.2 g产品,溶解,配成250 mL溶液
b.量取25.00 ml待测液于锥形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4 溶液滴定至终点,消耗KMnO4溶液体积35.00 mL。
据此,请分析:
(1)滴定时反应的离子方程式为(完成并配平离子反应方程式)。

(2)滴定达到终点的标志是 。
(3)产品中FeSO4·7H2O的质量分数为 。
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)【化学—选修3:物质结构与性质】
a、b、c、d、f五种前四周期元素,原子序数依次增大;a、b、c三种元素的基态原子具有相同的能层和能级,第一电离能I1(a)<I1(c)<I1(b),且其中基态b原子的2p轨道处于半充满状态; d为周期表前四周期中电负性最小的元素;f的原子序数为29。请回答下列问题。(如需表示具体元素请用相应的元素符号)
(1)写出ac2的电子式__________;基态f原子的外围电子排布式为 。
(2)写出一种与ac2互为等电子体的物质的化学式 。
(3)b的简单氢化物的沸点比同族元素氢化物的沸点 。(填“高”或“低”)

(4)化合物M由c、d两种元素组成,其晶胞结构如甲,则M的化学式为 。
(5)化合物N的部分结构如乙,N由a、b两元素组成,则硬度超过金刚石。试回答:①N的晶体类型为________________________,其硬度超过金刚石的原因是___________________。
②N晶体中a、b两元素原子的杂化方式均为___________________。
查看答案和解析>>
科目: 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(15分)【化学—选修5:有机化学基础】
已知有机物A~I之间的转化关系如下图所示:

已知:
①A与D、B与E、I与F互为同分异构体
②将新制Cu(OH)2悬浊液分别加入到有机物I、F中,加热,I无明显现象,F反应并生成砖红色物质
③C的实验式与乙炔相同,且相对分子质量为104
④E的一种同分异构体与FeCl3能发生显色反应
根据以上信息,回答下列问题:
(1)H、 F中含有的含氧官能团名称分别为 、 。
(2)反应①~⑨中属于消去反应的是____________________________。
(3)I的结构简式为____________________________。
(4)写出H在酸性条件下水解的化学方程式 。
(5)写出F与银氨溶液反应的化学方程式 。
(6)符合以下条件的G的同分异构体有________种;其中苯环上只有2种一元取代物的结构简式为 。
①属于芳香族化合物
②能与NaOH溶液反应
③能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com