
科目: 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:选择题
由几种常见的盐混合组成的白色粉末,其中只可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、NO2-中的若干种离子。某同学对该溶液进行如下实验:

以下说法正确的是
A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3-
B.气体乙一定是NO和NO2的混合气体
C.白色沉淀乙是BaSO4,所以原混合物一定含有SO42-
D.白色粉末中一定含有Na+ 、Al3+ 、NO2-
查看答案和解析>>
科目: 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:填空题
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
查看答案和解析>>
科目: 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:简答题
(14分)研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
则CH4(g)+CO2(g) 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如下图所示。

?据图可知,P1 、P2、 P3 、P4 由大到小的顺序 。
?在压强为P4、1100℃的条件下,该反应5min时达到平衡点X,则用CO表示该反应的速率为 。该温度下,反应的平衡常数为 。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g)  CO(g)+H2 (g)来制取。
CO(g)+H2 (g)来制取。
①在恒温恒容下,如果从反应物出发建立平衡,可认定平衡已达到的是
A.体系压强不再变化 B.H2与CO的物质的量之比为1 :1
C.混合气体的密度保持不变 D. 气体平均相对分子质量为15,且保持不变
② 在某密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、
2.2molH2(g)和一定量的C(s),如果此时对体系加压,平衡向 (填“正”或“逆”)反应方向移动,第5min时达到新的平衡,请在下图中画出2~5min内容器中气体平均相对分子质量的变化曲线。

查看答案和解析>>
科目: 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:实验题
(15分)乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。
乙酰苯胺的制备原理为: 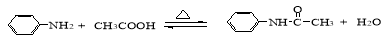
实验参数:
名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
苯 胺 | 93 | 无色油状液体, 具有还原性 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
实验装置:(见右图)
注:刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离
实验步骤:
步聚1:在100ml圆底烧瓶中加入无水苯胺9.1mL,冰醋酸17.4mL,锌粉0.1g,安装仪器,加入沸石,给反应器均匀加热,使反应液在微沸状态下回流,
调节加热温度,使柱顶温度控制在105℃左右,反应约60~80min,反应生成的水及少量醋酸被蒸出,当反应基本完成时,停止加热。
步聚2: 在搅拌下,趁热将烧瓶中的物料以细流状倒入盛有100mL冰水的烧杯中,剧烈搅拌,并冷却烧杯至室温,粗乙酰苯胺结晶析出,抽滤、洗涤、干燥,得到乙酰苯胺粗品。
步聚3: 将此粗乙酰苯胺进行重结晶,待结晶完全后抽滤,尽量压干滤饼。产品放在干净的表面皿中晾干,称重,计算产率。
请回答下列问题:
(1)实验中加入锌粉的目的是
(2)为何要控制分馏柱上端的温度在105?C左右
(3)通过什么现象可判断反应基本完成
(4)步聚1加热可用 (填“水浴”或“油浴”),步聚2中结晶时,若冷却后仍无晶体析出,可采用的方法是 。
(5)洗涤乙酰苯胺粗品最合适的试剂是 。
A. 用少量冷水洗 B. 用少量热水洗
C. 先用冷水洗,再用热水洗 D. 用酒精洗
(6)该实验最终得到纯品8.1克,则乙酰苯胺的产率是 。
查看答案和解析>>
科目: 来源:2013-2014浙江省湖州市高三二模理综化学试卷(解析版) 题型:推断题
(15分)丙烯可用于合成应用广泛的DAP树脂单体。下列反应流程中的反应条件和少量副产物省略。

已知: RCOOR’+R’’OH→RCOOR’’+R’OH(R、R’、R’’代表烃基)

(1)DAP树脂单体的分子式为 。
(2)B中所含官能团的名称是 ,B→C的反应类型 。
(3)E的相对分子质量为162, 1H核磁共振有3个信号。写出E的结构简式 。
(4)请写出反应②的化学方程式 。
(5)D有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 。
A.能与NaOH溶液反应
B.苯环上只有两个相同的取代基,且苯环上的一氯代物有两种
(6)以丙烯为原料,其他无机试剂任选,写出制备硝化甘油的合理流程图,注明试剂和
条件。注:合成路线的书写格式参照如下实例流程图:
CH3CHO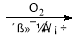 CH3COOH
CH3COOH CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.红外光谱仪、质谱仪、核磁共振仪、紫外光谱仪和元素分析仪都是用于测定有机物结构的现代仪器
B.工业上采用电解熔融氧化铝的方法冶炼铝,为了降低氧化铝的熔点,在实际生产中,向氧化铝中添加冰晶石
C.化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA分子双螺旋结构模型的提出奠定了基础
D.雾霾天气首要污染物为PM2.5(指大气中直径小于或等于2.5微米的颗粒物),PM2.5在空气中一定形成气溶胶
查看答案和解析>>
科目: 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.金属汞一旦洒落,必须尽可能收集起来,放在水中保存以防挥发;并将硫磺粉撒在洒落的地方,使金属汞转变成不挥发的硫化汞
B.胶状沉淀和颗粒太小的沉淀不能用抽滤的原因是在快速过滤时沉淀易透过滤纸
C.用移液管吸取溶液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管
D.将水杨酸、乙酸酐和浓硫酸在锥形瓶中混合后,水浴加热,一段时间后取出锥形瓶,为使阿司匹林完全结晶需向锥形瓶中加适量的水,并将锥形瓶置于冰水浴中
查看答案和解析>>
科目: 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
五种短周期元素的某些信息如表所示:
元素 | 有关信息 |
X | 最高价氧化物对应的水化物能与其气态氢化物反应生成盐 |
Y | M层上有3个电子 |
Z | 短周期元素中原子半径最大的主族元素 |
W | 其单质是淡黄色固体 |
Q | 最高正价与最低负价代数和为6 |
下列说法正确的是
A.简单离子的半径大小顺序为:W>Q>Z>Y
B.Z单质在氧气中燃烧后的产物不能使品红溶液褪色
C.单质熔点高低的顺序为:Z>Y>X
D.Z与W元素只能形成原子个数比为2:1的化合物
查看答案和解析>>
科目: 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
钛被称为21世纪金属。研究发现,用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用图所示装置制备金属钛。下列叙述正确的是

A.乙装置阴极的电极反应式为
TiO2+4e-=Ti+2O2-
B.若不考虑能量的损失,制备24.0g
金属钛,需要消耗金属铝36.0g
C.甲装置工作过程中OH-向AgO/Ag极移动;乙装置工作过程中O2-向钛网移动
D.乙装置中的石墨电极需要定期更换
查看答案和解析>>
科目: 来源:2013-2014浙江省高三下学期联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.按系统命名法, 有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的名称是:2-甲基-3-丙基戊烷
B. 分子中所有原子共平面
分子中所有原子共平面
C.某蔗糖酯可以由蔗糖与硬脂酸乙酯合成,反应如下:
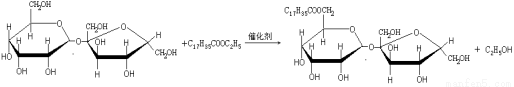
该蔗糖酯在稀硫酸的作用下水解能得到三种有机产物
D.荧光黄的结构简式为 ,其分子式为C20H12O5,理论上1mol该有机物最多消耗2molNaOH,并能与双缩脲试剂发生显色反应
,其分子式为C20H12O5,理论上1mol该有机物最多消耗2molNaOH,并能与双缩脲试剂发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com