
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.2 NA
B.常温常压下, 18 g H2O中含的质子数为10 NA
C.标准状况下,11.2 L CH2Cl2中含有的分子数目为0.5 NA
D.常温常压下, 2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
符合下列条件的有机物同分异构体共有(不考虑立体异构) ( )
①分子式为C6H14O ②在铜或银催化剂的条件下可以被空气中的氧气氧化为醛
A.6种 B.7种 C.8种 D.9种
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
下列关于有机物叙述不正确的是( )
A.甲烷、甲苯、乙醇、乙酸都可以发生取代反应
B.煤中含有苯、甲苯、二甲苯等芳香烃,可通过干馏制取
C.蔗糖可以水解生成葡萄糖和果糖
D.植物油通过加氢可以变为脂肪
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
如图表示水中c(H+)和c(OH-)的关系,下列判断错误的是

A.两条曲线间任意点均有c(H+)·c(OH-)=Kw
B.M区域内任意点均有c(H+)<c(OH-)
C.图中T1<T2
D.XZ线上任意点均有pH=7
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH 的关系如图所示。
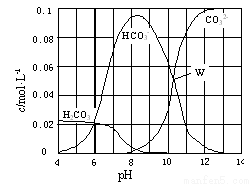
下列有关溶液中离子浓度关系叙述正确的是 ( )
A.W点所示的溶液中:c(Na+)+ c(H+)=2c(CO32-)+ c(OH-)+ c(Cl-)
B.pH=4的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+ c(H2CO3)+ c(HCO3-) = c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3)
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:选择题
X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是 ( )
A.X2-的还原性一定大于Y-
B.由mXa+与nYb- 得m+a = n-b
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:实验题
实验室制备乙酸乙酯的反应和实验装置如下:
CH3COOH + C2H5OH 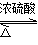 CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料 1 : 1 产率 65%
1 : 10 97%
(在120 ℃下测定)

已知:相关物理性质(常温常压)
| 密度g/mL | 熔点/℃ | 沸点/℃ | 水溶性 |
乙醇 | 0.79 | -114 | 78 | 溶 |
乙酸 | 1.049 | 16.2 | ~117 | 溶 |
乙酸乙酯 | 0.902 | ?84 | ~76.5 | 不溶 |
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机制
用乙醇羟基氧示踪

用醋酸羟基氧示踪


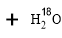
含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机制 。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K= 。
为了使正反应有利,通常采用的手段是:
①使原料之一过量。谁过量 ?
无水乙醇3600元/吨,冰醋酸2900元/吨。每摩乙醇 元,每摩冰醋酸 元。
②不断移走产物[例如除水,乙酸乙酯、乙醇、水可形成三元恒沸物(沸点:70.2 ℃),乙酸不能形成三元恒沸物]。综上所述选择 过量。
(3)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(4)浓硫酸与乙醇如何混合? 。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是? 。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质? 。
饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净? 。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水? 。
用饱和CaCl2溶液直接洗涤起什么作用: 。
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:填空题
氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
(2)工业上氨气可以由氢气和氮气合成。
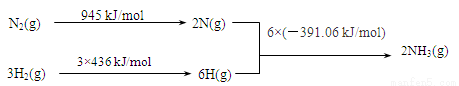
①该反应的热化学方程式是 。
②简述一种检查氨气是否泄露可采用的化学方法: 。
(3)下表是当反应器中按n(N2):n(H2)=1:3投料后,在200℃、400℃、600℃下,反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线。
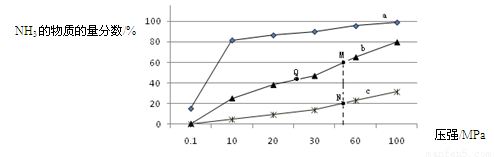
①曲线a对应的温度是 。
②关于工业合成氨的反应,下列叙述正确的是 (填字母)。
A. 及时分离出NH3可以提高H2的平衡转化率
B. 加催化剂能加快反应速率且提高H2的平衡转化率
C. 上图中M、N、Q点平衡常数K的大小关系是K(M)= K(Q) >K(N)
③ M点对应的H2转化率是 。
(4)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用
氨水吸收法处理尾气。
① 当氨水中所含氨的物质的量为3 mol ,吸收标准状况下44.8 L SO2时,溶液中的溶
质为 。
② (NH4)2SO3显碱性,用化学平衡原理解释 。
③ NH4HSO3显酸性。用氨水吸收SO2,当吸收液显中性时,溶液中离子浓度关系正确
的是 (填字母)。
a.c(NH4+) = 2c(SO32-) + c(HSO3-)
b.c(NH4+)> c(SO32-)> c(H+)= c(OH-)
c.c(NH4+)+ c(H+)= c(SO32-)+c(HSO3-)+c(OH-)
(5)氨气是一种富氢燃料,可以直接用于燃料电池,下图是供氨水式燃料电池工作原理:

①氨气燃料电池的电解质溶液最好选择 (填“酸性”、“碱性”或“中性”)溶液。
②空气在进入电池装置前需要通过过滤器除去的气体是 。
③氨气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池的电极总反应是 ,正极的电极反应方是 。
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:填空题
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:

①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
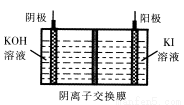
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目: 来源:2013-2014河南省洛阳市高三下学期统考二练理综化学试卷(解析版) 题型:填空题
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
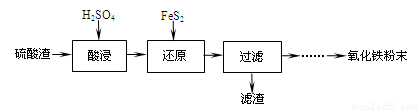
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,② 。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为
。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量 (填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量 。
(4)①可选用 (填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是
(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a. 氧化: ;
b. 沉淀: ;
c. 分离,洗涤; d. 烘干,研磨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com