
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。已知反应
Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-发生转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是 ( )( )。
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列溶液中微粒浓度关系一定正确的是( )
A.常温下,氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+)
B.常温下,pH=2的一元酸和pH=12的一元强碱等体积混合: c(OH-)=c(H+)
C.0.1 mol·L—1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+)
D.0.1 mol·L—1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S)
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大。下列有关双酚A的叙述不正确的是( )
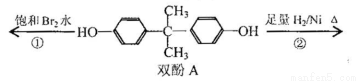
A.双酚A的分子式是C15H16O2
B.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
C.反应①中,1mol双酚A最多消耗2 mol Br2
D.反应②的产物中只有一种官能团
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
铁镍蓄电池又称爱迪生电池,放电时的总反应为: Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是 ( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池放电时,负极反应为Fe+2OH--2e-= Fe(OH)2
C.电池充电过程中,阴极附近溶液的pH降低
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )
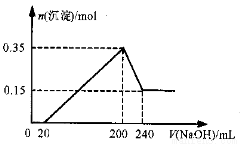
A.Mg和Al的总质量为8g
B.硫酸的物质的量浓度为5 mol/L
C.生成的H2在标准状况下的体积为11.2L
D.NaOH溶液的物质的量浓度为5mol/L
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.向Na2SO3溶液中通入足量氯气:SO32-+Cl2+H2O=SO42-+2Cl-+2H+
C.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-=Mn2++Cl2↑+2H2O
D.钠与CuSO4溶液反应:2Na+Cu2+===Cu+2Na+
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:推断题
(10分)短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A位于同一主族;在同周期元素形成的简单离子中,E的离子半径最小。
(1)实验室中可用A2C2制取C单质,其化学方程式是
(2)由A、C、D三种元素组成的化合物的电子式是 ;B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是 (用离子方程式表示)。
(3)反应乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是 (填“正”或“负”)极,在碱性条件下其电极反应是
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:填空题
(8分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1) 工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO (g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
①上述反应符合“原子经济”原则的是________(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250 ℃ | 300 ℃ | 350 ℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断,ΔH1______0(填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________,此时的温度为________(从上表中选择)。
(2)下列各项能作为判断反应Ⅰ在2 L的密闭容器中达到化学平衡状态的依据的是_______(填序号字母)。
A.容器内CO、H2、CH3OH的浓度之比为1∶2∶1
B.2v(H2)(正) = v(CO)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH1=-1 275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH3=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:实验题
(12分)某研究小组欲探究SO2的化学性质,设计了如下实验方案。
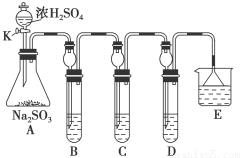
(1)在B中检验SO2的氧化性,则B中所盛试剂可为________。
(2)在C中装FeCl3溶液,检验SO2的还原性,则C中反应的离子方程式为__________________________。
(3)在D中装新制漂白粉浓溶液。通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分进行了探究。请回答下列问题:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1盐酸、0.5 mol·L-1H2SO4溶液、0.5 mol·L-1BaCl2溶液、品红溶液、新制澄清石灰水。
(ⅰ)假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为________;
假设三:该白色沉淀为上述两种物质的混合物。
(ⅱ)基于假设一,填写下表:
实验操作 | 预期现象和结论 |
将D中沉淀过滤,洗涤干净备用 |
|
用另一干净试管取少量沉淀样品,加入 ______ | __________ |
(ⅲ)若假设二成立,试写出生成该白色沉淀的化学方程式:
__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com