
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
已知反应3A(g)+B(g) C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )
C(s)+4D(g) ΔH<0,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是( )

①增大B的浓度 ②升高反应温度
③缩小反应容器的体积(加压) ④加入催化剂
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
A.a>b B. 平衡向正反应方向移动
C.A的转化率减小 D.B的质量分数减小
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,由此可判断( )
C(g)+D(g)过程中的能量变化如图所示,由此可判断( )
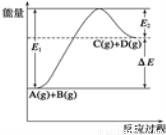
A.1molA与1molB充分反应后,能量变化为ΔE
B.加入催化剂后,反应加快,ΔE减小
C.反应物的总键能小于生成物的总键能
D.反应达到平衡时,升高温度,A的转化率增大
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
下列说法或表示方法中正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨)ΔH= -1.9KJ/mol 可知,金刚石比石墨稳定
C.由2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1可知,H2的燃烧热为-571.6 kJ·mol-1
D.稀溶液中:H+(aq)+OH—(aq)=H2O(l) ΔH= —53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
两种大气污染物NO2和SO2在一定条件下可发生如下反应:NO2 + SO2 NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
NO + SO3,在体积为VL的密闭容器中通入amolNO2和bmolSO2,反应后容器内硫原子和氧原子的个数比为( )
A. B.
B.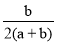 C.
C.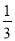 D.
D.
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是( )
A.10 min内,T1时CH4的化学反应速率比T2时小 B.温度:T1<T2
C.ΔH:a < 0 D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:填空题
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1
H2(g) + 1/2 O2(g)  H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1
CO(g) + 1/2 O2(g)  CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1
则煤的气化主要反应的热化学方程式是:C(s) + H2O(g)  CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2  2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:填空题
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇, 一定条件下发生如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)写出该反应的平衡常数表达式:K= ;已知:K(300℃)>K(350℃),则该反应是_______反应。(填“吸热”或“放热”)
(2)下列情况不能说明该反应一定达到平衡的是
A混合气体的平均平均相对分子质量不变 B混合气体的压强不变
C单位时间内生成3mol H—H键,同时生成2 mol C=O键
D.混合气体中 c (H2) : c (CH3OH) = 3:1
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为 mol·L-1·min-1

(4)下列措施中能使(3)题中n(CH3OH)/n(CO2)增大的有 。(填字母)
A升高温度 B加入催化剂 C将H2O(g)从体系中分离
D充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(5)若在另一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,并使初始体积与(3)题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数 ________ (3)题中的CO2的体积百分数。(填“>”或“<”或“=”)
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:填空题
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1) E元素在周期表中的位置 ;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是
(用化学式表示);写出C与A形成的18e-化合物的电子式 ,
该化合物类型为 (填“共价化合物”或“离子化合物”)
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式
;写出题中生成M的化学方程式
查看答案和解析>>
科目: 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:实验题
如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。

(l)写出装置A中所发生的化学反应
(2)装置B中盛放试剂是
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产
生 (填写反应现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式
(4)已知Cu2O是一种红色固体物质, 在高温条件下可由CuO分解得到:4CuO=2Cu2O+O2↑,生成的Cu2O 也能被NH3还原。当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是 (用化学式表示)
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com