
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
NA为阿伏加德罗常数,下列说法正确的是( )
A.106gNa2CO3晶体中的离子总数大于3NA
B. 0.2mol Zn与一定量浓H2SO4恰好完全反应,生成的气体分子数为0.2NA
C.将2mL 0.5mol·L-lNa2SiO3溶液滴入稀盐酸中制得H4SiO4胶体,所含胶粒数为0.001NA
D.电解精炼铜时,当阳极上质量减少6.4g时,电路上转移的电子数目为0.2NA
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
分子式为C3H2Cl6的同分异构体共有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
下列离子或分子组中大量共存且满足相应要求的是( )
A.K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液
B.Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体
C.Na+、K+、Ag+,NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失
D.NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向l00mL该条件下的CaSO4饱和溶液中加入400mL 0.0lmol·L-l的Na2SO4溶液,针对此过程的下列叙述正确的( )
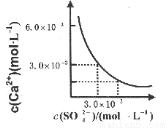
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c (SO4-)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(S042-)较原来大
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
在阿司匹林的结构简式(如图)中①②③④⑤⑥分别标出了其分子不同的键。将阿司匹林与足量NaOH溶液共热时,发生反应时断键的位置是( )
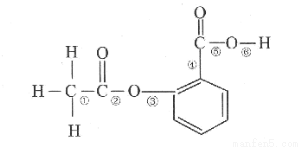
A.①④
B.②⑤
C.③④
D.②⑥
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
下列各组稀溶液( )
①NaHSO4和Na2CO3②AICl3和NaOH
③NH4HSO4和Ba(OH)2④H3PO4和Ca(OH)2
只用试管、滴管及闻气味就能鉴别有几组:
A.1组 B.2组 C.3组 D.4组
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是 ( )
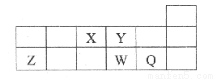
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为:rx> rY> rz> rQ
C,离子Y2-和Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:填空题
(14分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有杂质Fe2O3。利用明矾石来制取纯净的Al2O3、K2FeO4和H2SO4的工艺流程如图所示。

请回答下列问题:
(1)焙烧炉中发生反应的化学方程式为2Al 2(SO4) 2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
2Al2O3+6SO2↑+3O2↑,若生成102gAl2O3,转移的电子数目为 .
(2)生成沉淀I的离子方程式为 ,沉淀II的化学式为 。
(3)溶液经加硫酸调节pH后,过滤,洗涤,可得沉淀I,证明沉淀I已洗涤干净的实验操作和现象是 。
(4)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式: 。
(5)从滤液中得到K2SO4晶体的方法是 。
(6) K2FeO4也可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的
阳极反应式: .
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:填空题
(14分)运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应
 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
查看答案和解析>>
科目: 来源:2013-2014江西省上饶市高三六校第二次联考理综化学试卷(解析版) 题型:填空题
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
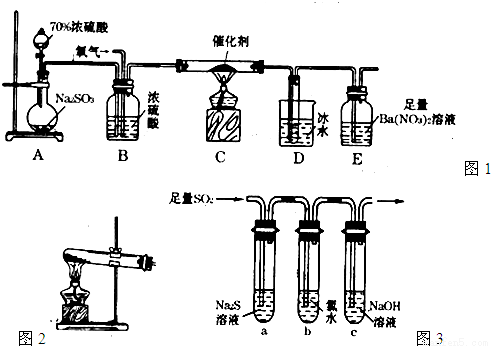
(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com