
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
肼(N2H4)是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A.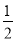 N2H4(g)+
N2H4(g)+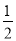 O2(g)===
O2(g)=== N2(g)+H2O(g) ΔH=+267 kJ·mol-1
N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
科学家根据元素周期律和原子结构理论预测,原子序数为114的元素属于第七周期ⅣA族, 称为类铅元素。下面关于它的原子结构和性质预测正确的是
A.类铅元素原子的最外层电子数为4 B.其常见价态为+2、+3、+4
C.它的金属性比铅弱 D.它的原子半径比铅小?
查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
0.3 mol Cu与足量的稀HNO3完全反应时,被还原的HNO3的物质的量是
A.0.3 mol B.0.6mol C.0.4 mol D.0.2 mol
查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a 是单质;b在通常状况下是气体; c、d都是氧化物;e是该元素的最高价
氧化物对应水化物,且是一种强电解质,则a可能是

A.N2 B.C12 C.Si D.C
查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:选择题
短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A.原子半径A<B<C B.A的氢化物的稳定性大于C的氢化物的稳定性
C.C的氧化物的熔点比A的氧化物的低 D.A与C可形成离子化合物
查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:填空题
(6分)把0.04 mol X气体和0.06 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4X(g)+5Y(g)===nZ(g)+6W(g);2 min末生成0.03 mol W。若测知以Z的浓度变化表示的反应速率为0.005 mol·(L·min)-1。试计算:
(1)前2 min内用X的浓度变化表示的平均反应速率为 ;
(2)化学方程式中n的值是 。
查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:填空题
(27分)(1)现有如下两个反应:①NaOH + HCl = NaCl + H2O;②Fe +H2SO4 = FeSO4 + H2 ↑
两反应中为放热反应的是 ,能设计成原电池的是 。(填序号)
(2)根据下图填空① 电子从 片流出,溶液中H+向 片移动。

② 正极的现象是 ,发生 反应(填写“氧化”或“还原”)。
③负极的电极方程式为
④ 若反应过程中有0.01mol电子发生转移,则生成的氢气在标准状况下的体积为 L。
(3)写出电解氯化铜溶液时,阴极的电极反应方程式: 。
查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:填空题
(24分)下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 |
|
|
| ① | ② | ③ | ④ |
|
3 | ⑤ | ⑥ | ⑦ |
|
|
| ⑧ |
|
4 | ⑨ | ⑩ |
|
|
|
|
|
|
(1)被选作相对原子质量标准的核素是 (填核素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素在第 族;写出它的氧化物与氢氧化钠溶液反应的离子方程式 。
(4)从⑤到⑧的元素中, 原子半径最大(填元素符号)。
(5)元素④与⑥形成的化合物属于 (填 “共价”或“离子”)化合物。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A、将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B、比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C、将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D、将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强
查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高一化学试卷(解析版) 题型:实验题
(18分)实验室常用下列装置制备、收集二氧化氮气体,并探究其性质。

(1)装置A中的分液漏斗里盛装的液体通常是 ,圆底烧瓶中预先加入的是铜片,但铁的价格比铜的价格低,此处用铜片不用铁片的原因是 。
(2)干燥管D中装的干燥剂是无水氯化钙,其作用是 。
(3)随着时间的推移,浓硝酸逐渐变稀,装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下:2NO2+2NaOH=NaNO3+NaNO2+H2O ;NO2+NO+2NaOH=2NaNO2+H2O
①NO和NO2混合气体的组成可表示成NOx,该混合气体通入NaOH溶液被完全吸收时,x的值可以为 (填字母)
A.1.1 B.1.2 C.1.5 D.1.8
②现有2.4mol NO2和1.2mol NO组成的混合气体,要用NaOH溶液使其完全吸收,最终无气体剩余。现有浓度为1mol/L的NaOH溶液,则需此NaOH溶液的体积至少是 L。
(4)在上述装置中,若改用其它收集装置,最后收集到的气体中无NO2气体,则采用的收集装置是 (选填“F”或 “G”)。

查看答案和解析>>
科目: 来源:2013-2014江苏省第二学期期中考试高二化学试卷(解析版) 题型:选择题
一定温度下,在固定容积的密闭容器中发生下列反应:2HI(g) H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
H2(g)+I2(g)。若HI浓度由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么HI浓度由0.07 mol·L-1降到0.05 mol·L-1时所需反应的时间为
A.等于5 s B.大于10 s C.等于10 s D.小于10 s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com