
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
以下表述不符合元素周期律的是
A.酸性:H3PO4>HNO3>HClO4
B.热稳定性:HF>H2O>NH3
C.离子半径:F->Na+>Mg2+
D.还原性:HI>HBr>HCl
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是
A.Na+(g)+Cl-(g)===NaCl(s) ΔH B.Na(s)+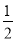 Cl2(g)===NaCl(s) ΔH1
Cl2(g)===NaCl(s) ΔH1
C.Na(g)-e-===Na+(g) ΔH2 D.Cl(g)+e-===Cl-(g) ΔH3
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
处于同一周期的A、B、C、D四种短周期元素,其气态原子获得一个电子所放出的能量A>B>C>D。则下列关于A、B、C、D四种元素的说法中,正确的是
A.元素的非金属性依次增强 B.元素的电负性依次减小
C.元素的第一电离能依次增大 D.最高价氧化物对应水化物的酸性依次减弱
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
常温下,含a mol CH3COOH和b mol NaOH的两溶液混合后,下列推论不正确的是
A.若a≤b,混合液的pH一定小于7
B.若a=2b,则混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-)
C.混合液中,c(Na+)+c(H+)=c(OH-)+c(CH3COO-)一定成立
D.当混合液的pH>7时,c(Na+)>c(CH3COO-)>c(OH-)>c(H+)一定成立
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
某温度下,将0.2 mol C(s)和0.3 mol H2O(g),投入2 L的密闭容器中,发生反应C(s)+H2O(g) CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
CO(g)+H2(g),5 min达到平衡后,密度增加了0.3 g·L-1。有关下列说法正确的是
A.从反应开始到平衡过程中,用C来表示该反应的平均速率为0.005 mol·L-1·min-1
B.达平衡时压强变为原来的7/6
C.此温度下该反应的平衡常数为0.005
D.若保持温度和体积不变,向平衡体系中再加入0.2 mol C(s)和0.3 mol H2O(g),重新达到平衡后,H2O的转化率等于16.7%
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
T ℃时,某NaOH溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12。向该溶液中逐滴加入pH=c的盐酸(T ℃),测得混合溶液的部分pH如表中所示:
序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 20.00 | 0.00 | 8 |
② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为
A.3 B.4 C.5 D.6
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:选择题
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如下图,下列判断错误的是
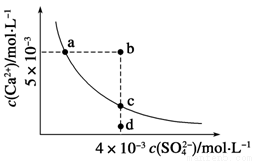
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO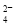 )一定等于3×10-3 mol·L-1
)一定等于3×10-3 mol·L-1
D.向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:填空题
(10分)在研究原子核外电子排布与元素周期表的关系时,人们发现外围电子排布相似的元素集中在一起。据此,人们将元素周期表重新分为五个区。在1-36号元素中
(1)在s区中,族序数最大的元素,其原子的价电子的电子云形状为 。
(2)在d区中,人类使用最早,应用最广泛的元素的常见离子的电子排布式为 , 。
(3)在ds区中,原子序数最大的元素,原子的价电子排布式为 。
(4)在p区中,第2周期、ⅤA族元素原子价电子的轨道表示式为 。
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:填空题
(14分)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)  (NH4)2CO3(aq)ΔH1
(NH4)2CO3(aq)ΔH1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)  NH4HCO3(aq)ΔH2
NH4HCO3(aq)ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)  2NH4HCO3(aq)ΔH3
2NH4HCO3(aq)ΔH3
请回答下列问题:
(1)ΔH3与ΔH1、ΔH2之间的关系是:ΔH3= 。
(2) 反应Ⅲ的化学平衡常数表达式为 。
(3)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①ΔH3 0(填“>”、“=”或“<”)。
②在T1~T2及T4~T5两个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是
。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化总趋势曲线。
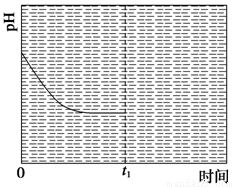
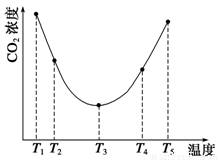
图1 图2
(4)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有
。
(5)下列物质中也可以作为CO2捕获剂的是 。
A.NH4Cl B.Na2CO3 C.HOCH2CH2OH D.HOCH2CH2NH2
查看答案和解析>>
科目: 来源:2013-2014江苏省高二下学期阶段测试5月 化学试卷(解析版) 题型:填空题
(16分)钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是 (用离子方程式表示)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示:
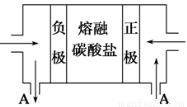
正极的电极反应式为 ,电池工作时物质A可循环使用,A物质的化学式为 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 11.6 | 10.3 | 11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01 mol·L-1下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为 。
②已知几种离子开始沉淀时的pH如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com