
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.常温下,0.1 mol·L-1 CH3COOH溶液的pH=1
B.铅蓄电池在放电过程中,负极质量增加,正极pH减少
C.反应CO2(g)+C(s)=2CO(g)在低温下不能自发进行,则其△H>0
D.常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
儿茶素(其结构简式如图所示)是茶叶的主要活性成分,具有抗氧化、抗菌、除臭等作用。下列说法正确的是
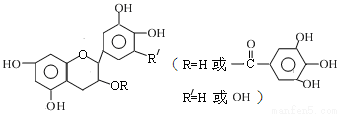
A.常温下,儿茶素不溶于水,也不溶于有机溶剂
B.儿茶素能与FeCl3溶液发生显色反应
C.1 mol儿茶素最多可与9mol NaOH反应
D.儿茶素一定不能发生水解反应
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
下列有关溶液配制操作对溶液浓度的影响和原因分析都正确的是
选项 | 溶液配制操作 | 影响 | 原因分析 |
A | 将2 g I2加入到98 mL CCl4中溶解混匀后,即得质量分数为2%的I2的CCl4溶液 | 偏小 | CCl4的密度 大于1 g/mL |
B | 配制一定浓度的溶液时,将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外 | 偏小 | 洒出的溶液中含有溶质 |
C | 配制一定物质的量浓度的硝酸溶液,定容时加入的水超过了刻度线,立即用滴管吸出多余的水,再摇匀 | 无影响 | 吸出了多余 的水 |
D | 配制一定物质的量浓度的食盐溶液,定容,摇匀后发现液面低于刻度线 | 偏大 | 液体的体积 偏小 |
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
25 ℃时,2a mol·L-1次氯酸水溶液中,用NaOH溶液调节其pH(忽略溶液体积的变化),得到c(HClO)、c(ClO-)与溶液pH的变化关系如图所示。下列说法正确的是
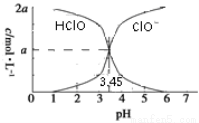
A.当pH=2时,溶液中c(ClO-)>c(Na+)
B.当c(ClO-)>c(HClO)时,溶液一定呈碱性
C.当pH=3.45时,所加NaOH溶液恰好与HClO完全反应
D.当pH=5时,溶液中:c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
在一个容积为2 L的恒容密闭容器中加入0.2 mol CO和0.4 mol H2,发生反应:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
实验测得在300℃和500℃时,甲醇的物质的量(mol)随时间的变化如下表所示。
| 10 min | 20 min | 30 min | 40 min | 50 min | 60 min |
300℃ | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
500℃ | 0.120 | 0.150 | 0.156 | 0.160 | 0.160 | 0.160 |
下列说法正确的是
A.该反应的ΔH>0,升高温度,化学平衡常数K增大
B.300℃时,前20 min内的反应速率v(H2)=0.003 mol·L-1·min-1
C.采取加压、增大c(H2)、加入合适的催化剂等措施都能提高CO的转化率
D.500℃时,在起始时向容器中加入0.1 mol CO和0.3 mol H2,可计算出反应达平衡后甲醇的浓度
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:实验题
(12分)硫酸铜在生产、生活中应用广泛。某化工厂用含少量铁的废铜渣为原料生产胆矾的流程如下:

(1)写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式: 。
(2)取样检验是为了确认Fe3+是否除净,你的检验方法是 。
(3)滤渣c是 。
(4)气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为:
2NO+O2 =2NO2、 。
(5)一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,写出硫酸铜受热分解的化学方程式: 。
某同学设计了如下图所示的实验装置分别测定生成的SO2气体、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由: 。
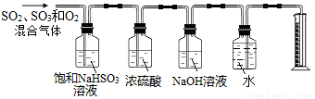
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:推断题
(15分)化合物莫沙朵林(F)是一种镇痛药,它的合成路线如下(其中的THF是有关反应的催化剂):
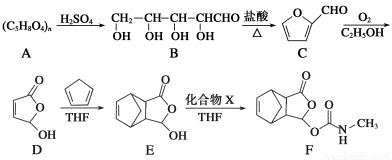
(1)化合物C中的含氧官能团的名称为 、 。化合物E的分子中含有的手性碳原子数为 。1 mol F最多可与 mol NaOH反应。
(2)化合物C与新制氢氧化铜的悬浊液反应的化学方程式为 。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式: 。
Ⅰ.分子的核磁共振氢谱图(1H核磁共振谱图)中有4个峰;Ⅱ.能发生银镜反应和水解反应;Ⅲ.能与FeCl3溶液发生显色反应,且与溴水反应。
(4)已知E+X→F为加成反应,则化合物X的结构简式为 。
 (5)已知:
(5)已知: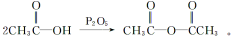 化合物G(结构如右下图所示)是合成抗病毒药阿昔洛韦的中间体。请写出以OHCCH(Br)CH2CHO
化合物G(结构如右下图所示)是合成抗病毒药阿昔洛韦的中间体。请写出以OHCCH(Br)CH2CHO
和1,3—丁二烯为原料制备G的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:实验题
(12分)Na2S2O3(俗称保险粉)在医药、印染中应用广泛,可通过下列方法制备:取15.1 gNa2SO3溶于80.0 mL水。另取5.0 g硫粉,用少许乙醇润湿后加到上述溶液中。小火加热至微沸,反应1小时后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3·5H2O。
(1)加入的硫粉用乙醇润湿的目的是 。
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机化合物杂质是 ;其检测的方法是:取出少许溶液,加盐酸至酸性后,过滤除去S,再加BaCl2溶液。则加入的盐酸发生两个反应的化学方程式为:
Na2SO3+2HCl=SO2↑+H2O+2NaCl; 。
(3)某环境监测小组用含0.100 mol·L-1Na2S2O3溶液[含少量的Na2SO3,且n(Na2S2O3) ∶n(Na2SO3)
= 5∶1]测定某工厂废水中Ba2+的浓度。他们取废水50.0 mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀硫酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,用上述Na2S2O3溶液进行滴定,反应完全时,测得消耗Na2S2O3溶液的体积为36.0 mL。
(已知有关反应的离子方程式为:①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-;③I2+SO32-+H2O 2I-+SO42-+2H+)
则滴定过程中可用 作指示剂。计算该工厂废水中Ba2+的物质的量浓度。
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:实验题
(15分)某研究小组用黄铜矿(主要成分是CuFeS2,其中S为-2价)为主要原料炼铜,其总反应为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。事实上该反应是按如下流程分步进行的:
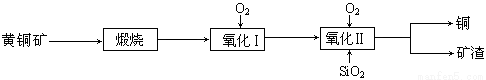
(1)氧化Ⅰ的反应主要是煅烧生成的硫化亚铁被进一步氧化为氧化亚铁,并与二氧化硅反应生成矿渣。矿渣的主要成分是 (填化学式)。
(2)据报道,有一种细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的。该反应的化学方程式为 。
(3)我国学者研究发现,以精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,生产成本能够降低许多。有关实验结果如下表:
沸腾炉温度/℃ | 560 | 580 | 600 | 620 | 640 | 660 |
水溶性Cu/% | 90.12 | 91.24 | 93.50 | 92.38 | 89.96 | 84.23 |
酸溶性Cu/% | 92.00 | 93.60 | 97.08 | 97.82 | 98.16 | 98.19 |
①CuFeS2与O2反应的化学方程式为 。
②实际生产过程中沸腾炉温度为600~620 ℃。则控制温度的方法是 。
③当温度高于600~620 ℃时,生成物中水溶性铜下降的原因是 。
④生成物冷却后的除铁的实验操作方法主要是 。已知在溶液中,Cu2+开始沉淀和沉淀完全的pH分别为4.7、6.7,Fe3+开始沉淀和沉淀完全的pH分别为1.1、3.2;如果制得的硫酸铜溶液中含有少量的Fe3+,请写出除去溶液中Fe3+的实验操作步骤: 。
查看答案和解析>>
科目: 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:填空题
(14分)甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。已知:
光催化制氢:2H2O(l)===2H2(g)+O2(g) ΔH=+571.5 kJ/mol ①
H2与CO2耦合反应:3H2(g)+CO2(g)===CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol ②
则反应:2H2O(l)+CO2(g) = CH3OH(l)+3/2O2(g)的ΔH= kJ/mol。
你认为该方法需要解决的技术问题有 (填字母)。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
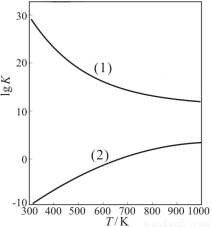
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应 (填“I”或“II”。下同)制甲醛的原子利用率更高。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。
②下图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示的是反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式: 。
(4)甲醇燃料电池的工作原理如图所示,则该电池负极的电极反应式为 。
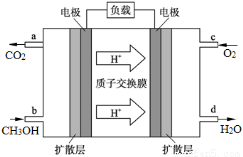
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com