
科目: 来源: 题型:推断题
由中学化学常见元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图所示转化关系,A是由地壳中含量最多的金属元素组成的。请回答:
(1)写出下列物质的化学式:乙_______、丁_______、戊_______
(2)写出甲物质在工业上的一种主要用途:_______
(3)写出甲→乙+丙反应的离子方程式:____________
A→乙+C反应的化学方程式______________
查看答案和解析>>
科目: 来源: 题型:推断题
(16分)以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;
“滤渣A”主要成份的化学式为 。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O="=" 15Fe2 + + SO42- + 。
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) 。
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目: 来源: 题型:推断题
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: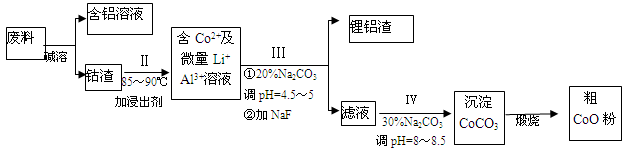
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。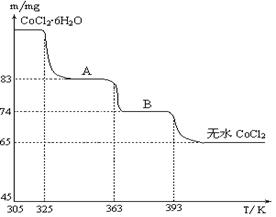
查看答案和解析>>
科目: 来源: 题型:推断题
有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白: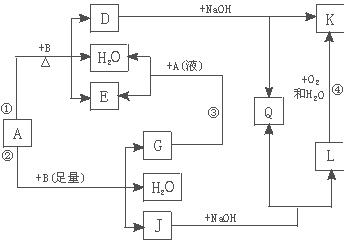
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):
查看答案和解析>>
科目: 来源: 题型:推断题
(11分)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示: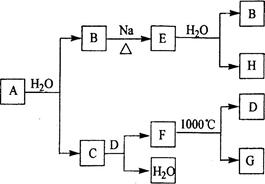
请回答下列问题:
(1)A与水反应的化学方程式为____________,E与水反应的化学方程式为______ _ ______;
(2)F的化学式为_____________,G和D的电子式分别为____________和______________;
(3)D与H反应可能生成的盐有_______ ______ (填化学式);
(4)如何由F制备A : 。
查看答案和解析>>
科目: 来源: 题型:实验题
(27分)氨的合成原理为:N2(g)+3H2(g)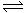 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题: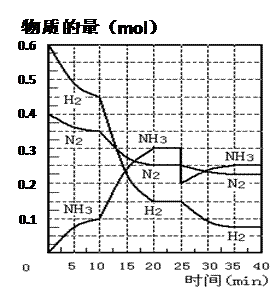
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
 2NH3(g) +
2NH3(g) + 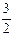 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1查看答案和解析>>
科目: 来源: 题型:单选题
如图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是
| A.从E口逸出的气体是H2 |
| B.从B口加入含少量NaOH的水溶液以增强导电性 |
| C.标准状况下每生成22.4L Cl2,同时产生2 mol NaOH |
| D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42一等离子,精制时先加Na2CO3溶液 |
查看答案和解析>>
科目: 来源: 题型:单选题
废电池造成污染的问题日益受到关注,集中处理废电池的首要目的是
| A.回收石墨电极 |
| B.回收电池外壳的金属材料 |
| C.防止电池中渗泄的电解液腐蚀其他物品 |
| D.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
查看答案和解析>>
科目: 来源: 题型:单选题
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料;⑥2M+N="2P+2Q" ,2P+M= Q
(M、N为原料,Q为期望产品),其中符合“化学反应的绿色化”的要求的是
| A.①③④⑤ | B.②③⑤⑥ | C.①②③④ | D.②④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com