
科目: 来源: 题型:推断题
下表为部分短周期元素化合价及其相应原子半径的数据。请回答下列问题:
(1)元素G在周期中的位置是 ;元素F所形成的常见单质的电子式为 。
(2)A、B、C、E的氢化物稳定性顺序是 。(用化学式回答)
(3)分子组成为ACH2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是 。
(4)请写出B的单质的一种重要用途 ;工业上制取该单质的原理反应为 。
(5)请设计一个实验方案,使铜和A的最高价氧化物对应的水化物的稀溶液反应,得到蓝色溶液和氢气。请在方框内绘出该实验方案原理装置示意图。
查看答案和解析>>
科目: 来源: 题型:推断题
某科研小组以难溶性钾长石(K2O?Al2O3?6SiO2)为原料,提取A12O3、K2CO3等物质,工艺流程如下:
(1)“煅烧”过程中有如下反应发生:
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式_____________________。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式____________________________。
(2)已知NaAlO2和KAlO2易发生如下反应:AlO2-+2H2O Al(OH)3+OH-。
Al(OH)3+OH-。
“浸取”时,应保持溶液呈______性(填“酸”或“碱”)。“浸取”时不断搅拌的目的是______________。
(3)“转化”时加入NaOH的主要作用是_______ (用离子方程式表示)。
(4)上述工艺中可以循环利用的主要物质是_______、_______和水。
查看答案和解析>>
科目: 来源: 题型:推断题
(共15分)
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______ ,
写出气体甲的电子式________ 。
(2)X的化学式是____ ,在惰性气流中加热X至完全分解的化学方程式为_______________ 。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是________________ 。
(用化学方程式表示)。
(4)一定条件下,气体甲与固体1中某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式____________________________________________________________,
并设计实验方案验证该反应的产物_________________________________________
。
查看答案和解析>>
科目: 来源: 题型:推断题
(12分)现有常见金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。其中B是地壳中含量最多的金属。它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: 乙 、H 。
(2)写出反应③的离子方程式: 。
写出反应⑦的离子方程式: 。
B与C的最高价氧化物反应的化学方程式 。
(3)实验室检验物质G中阳离子的常用试剂是: 。
查看答案和解析>>
科目: 来源: 题型:推断题
(12分)A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F为红褐色沉淀。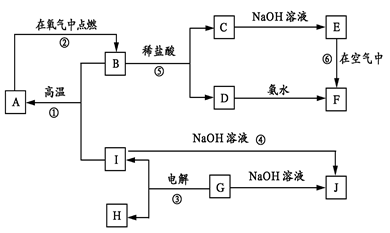
请填写下列空白:
(1) A、B、C、D、E、F六种物质中所含的同一种元素是 (写元素符号)。
(2) 写出物质C、G的化学式:C ,G 。
(3) 写出反应①、④的化学方程式:反应①: 。反应④: 。
查看答案和解析>>
科目: 来源: 题型:推断题
(10分)下列框图中,已知A、E、F、H是单质,其中只有A是固体,其它都是气体,且H是呈黄绿色;B是最常见液体,G的焰色反应呈黄色,L是白色沉淀,M是红褐色沉淀。部分反应的某些产物未标出。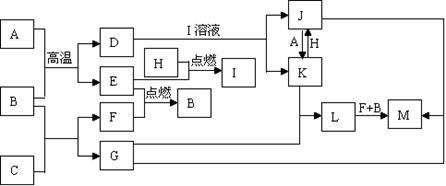
(1)写出H的化学式: 、C的电子式: 。
(2)写出D与I溶液发生反应的离子方程式: 。
(3)写出L→M的化学方程式: 。
(4)检验J中的阳离子时,不宜选用下列试剂中的 (填选项字母)。
A.Fe粉 B.NaOH溶液 C.KSCN溶液
查看答案和解析>>
科目: 来源: 题型:推断题
(本题16分)工业上用白云石制备高纯氧化镁的工艺流程如下: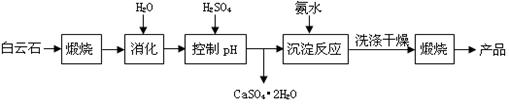
已知Ⅰ.白云石主要成分可表示为:CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%。
(1)为了提高白云石的煅烧效果,可以采取的措施是将矿石 。若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 (填序号)。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
(2)加入H2SO4控制pH时,终点pH对产品的影响如图8所示。则由图示可得到的结论及原因是:
①pH过高会导致___________________________下降,其原因是_______________________
②pH过低会引起____________________________ ,其原因可能是__________(填序号)
A.Fe2O3溶于H2SO4最终使产品混有杂质 B.SiO2溶于H2SO4最终使产品混有杂质
C.酸性过强,形成可溶的Ca(HSO4)2,最终使产品混有含钙的杂质
(3)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目: 来源: 题型:推断题
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。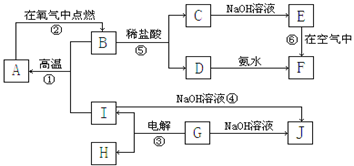
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置第 周期、第 族;
(2)写出反应①的化学方程式 ;
(3)写出反应④的离子方程式 ;
(4)写出反应③的电极方程式:
阳极: 阴极:
(5)从能量变化的角度看,①②③反应中属于△H<0的反应是 。(填序号)
查看答案和解析>>
科目: 来源: 题型:推断题
现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:(已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀)该同学得出的结论正确的是
| A.根据现象1可推出该试液中含有Na+ |
| B.根据现象2可推出该试液中并不含有葡萄糖酸根 |
| C.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+ |
| D.根据现象5可推出该试液中一定含有Fe2+ |
查看答案和解析>>
科目: 来源: 题型:推断题
(15分)
某学习小组利用某工业废弃固体(主要成分为Cu2S和Fe2O3)来研究相关物质的制备。设计方案如图所示:
已知:Ksp[Cu(OH)2]=6.0×10-20 ,Ksp[Fe(OH)2]=1.6×10-14 ,Ksp[Fe(OH)3]=1.0×10-38
(1) 废弃固体在空气中灼烧发生反应(有2种元素被氧化)的化学方程式为______。
(2) 溶液C通过_______、_________、过滤等操作得到Fe2(SO4)3晶体。
(3) 常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液D后,随即生成硫酸铜。这一过程中反应的化学方程式依次为4FeSO4 + O2 + 2H2SO4=2Fe2(SO4)3 + 2H2O和 。溶液D在这一过程中所起的作用是_______。
(4) 操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中加入试剂Y以调节pH使得铁元素全部形成沉淀(含铁元素的离子浓度小于10-5 mol·L-1)。试剂Y可以是 ,溶液的pH至少调节为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com