
科目: 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(8分)下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题。

(1)④、⑤、⑦的原子半径由大到小的顺序为______________(用元素符号表示)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为________>__________。
(3)④、⑥、⑦的气态氢化物的稳定性由弱到强的顺序是_______________。
(4)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式_______________________。
查看答案和解析>>
科目: 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)铜及其化合物在生产生活中有着广泛的应用,铜在化合物中的常见化合价有+1、+2。
(1)工业上可用Cu2S+O2 2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
2Cu+SO2反应制取粗铜,反应中被氧化的元素是_____,当消耗32 g Cu2S时,转移电子数目是____________。
(2)将少量铜丝放人适量的稀硫酸中,温度控制在50℃-60℃,加入H2O2,反应一段时间后可制得硫酸铜,发生反应的离子方程式为:__________________________。CuSO4溶液中加入一定量的Na2SO3溶液和NaCl溶液加热,生成CuCl沉淀,写出生成CuCl的离子方程式___________________________。
(3)某小组同学在做铜与浓硫酸反应的实验时,发现铜片表面有黑色固体生成。
①甲同学猜想:黑色固体是未来得及溶解于酸的CuO,其猜想可用化学方程式表示为:
Cu+H2SO4 ________________________________________________。
________________________________________________。
②乙同学认为:黑色固体除CuO外,还可能含有Cu2S和CuS,其理由可能是____(填字母)。
a. Cu2S和CuS都是黑色的
b.铜与浓硫酸在加热条件下反应,还可能放出O2
c.浓硫酸是氧化剂,铜是还原剂,Cu的化合价升高与S的化合价降低有多种可能
查看答案和解析>>
科目: 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(14分)为探究某铁碳合金与浓硫酸在加热条件下反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。

往圆底烧瓶中加入mg铁碳合金,并滴入过量浓硫酸,点燃酒精灯。
(1)装置B的作用是______________________________________。
(2)甲同学观察到装置C中有白色沉淀生成。他得出了使澄清石灰水变浑浊的气体是二氧化碳的结论。装置A中能产生二氧化碳的化学方程式为_______________。
(3)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B~C之间添加装置M,装置E、F中盛放的试剂分别是_____、__________。重新实验后观察到装置F中的现象是__________。
(4)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)。测定铁元素质量分数的实验步骤如下;
I.往烧瓶A中加入过量的还原剂铜粉使溶液中的Fe3+完全转化为Fe2+过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL。
①步骤II中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是___________________。
②滴定过程中_______________(填“需要”或“不需要")加入指示剂。
③铁碳合金中铁元素的质最分数为_____________________________。
查看答案和解析>>
科目: 来源:2014-2015学年湖南长沙市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(12分)已知: ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,W和Z互为同分异构体。
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z。F和E按1:2反应生成W,W和Z互为同分异构体。

回答下列问题:
(1)写出反应类型:①_____________________,②______________________________。
(2)写出下列反应的化学方程式:
③_____________________________________________________;
④_____________________________________________________。
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为_______________,_________________,_______________,______________。
(4)A的结构简式可能为_______________________________________(只写一种即可)。
查看答案和解析>>
科目: 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
能源可划分为一次能源和二次能源,直接来自自然界的能源称为一次能源;需依靠其他能源的能量间接制取的能源称为二次能源。下列叙述正确的是
A.水煤气是二次能源 B.水力是二次能源
C.天然气是二次能源 D.电能是一次能源
查看答案和解析>>
科目: 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
改变反应条件使化学平衡向正反应方向移动时,下列变化中正确的是
A.生成物浓度一定增大 B.生成物的物质的量分数一定增大
C.反应物的转化率一定增大 D.某生成物的产率可能提高
查看答案和解析>>
科目: 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
下列各说法中,正确的是 ( )
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
查看答案和解析>>
科目: 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
某温度下,反应2N2O5 4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
4NO2+O2开始进行时,c(N2O5)=0.040 8 mol/L。经1 min后,c(N2O5)=0.030 mol/L。则该反应的反应速率为( )
A.v(N2O5)=1.8×10-4 mol/(L·s) B.v(N2O5)=1.08×10-2 mol/(L·s)
C.v(NO2)=1.8×10-4 mol/(L·s) D.v(O2)=1.8×10-4 mol/(L·s)
查看答案和解析>>
科目: 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
已知298 K时,合成氨反应N2(g)+3H2(g)?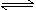 2NH3(g) ΔH=-92.0 kJ·mol-1,将此
2NH3(g) ΔH=-92.0 kJ·mol-1,将此
温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反
应放出的热量为(假定测量过程中没有能量损失) ( )
A.一定小于92.0 kJ B.一定大于92.0 kJ
C.一定等于92.0 kJ D.无法确定
查看答案和解析>>
科目: 来源:2014-2015学年甘肃天水市高二上第一阶段考试卷化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(g)+Y2(g) 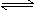 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A.Z为0.3 mol/L B.Y2为0.4 mol/L
C.X2为0.2 mol/L D.Z为0.4 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com