
科目: 来源: 题型:
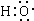 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同
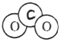
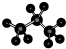
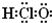
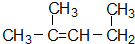 名称为1,3-二甲基-2-丁烯
名称为1,3-二甲基-2-丁烯| A、(1)(2)(4)(6) |
| B、(1)(2)(5)(8) |
| C、(1)(4)(5)(8) |
| D、(2)(3)(5) |
查看答案和解析>>
科目: 来源: 题型:
A、H2O2的电子式为 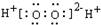 |
| B、4℃时,纯水的pH>7,呈中性 |
| C、100℃、101kPa时,水分子间距:液态>气态 |
| D、101kPa时,相同质量的水在不同状态下的能量:固态>液态>气态 |
查看答案和解析>>
科目: 来源: 题型:
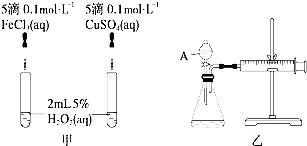 过氧化氢又名双氧水,具有较强的氧化性和还原性,在日常生活和生产中有重要用途.其电子式为
过氧化氢又名双氧水,具有较强的氧化性和还原性,在日常生活和生产中有重要用途.其电子式为查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
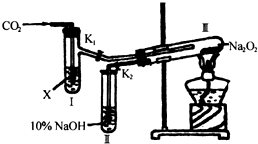 H2O2是无色液体,沸点比水高,不稳定、易分解生成H2O和O2.若向Na2O2中通入干燥CO2气体,Na2O2与CO2不反应.
H2O2是无色液体,沸点比水高,不稳定、易分解生成H2O和O2.若向Na2O2中通入干燥CO2气体,Na2O2与CO2不反应.
| ||
查看答案和解析>>
科目: 来源: 题型:
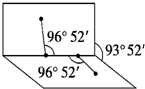 已知H2O2的结构如图:H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O-H键与O-O键的夹角均为96°52′,试回答:
已知H2O2的结构如图:H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O-H键与O-O键的夹角均为96°52′,试回答:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 消毒剂 | 化学式 | 性质和用途 | 备注 |
| 过氧乙酸 | CH3COOOH | 过氧乙酸易挥发、易分解,其分解产物是醋酸和氧气.过氧乙酸具有很强的消毒刹菌能力,可以迅速杀灭各种微生物、病毒和细菌等. | 醋酸对皮肤有腐蚀性 |
| 双氧水 | H2O2 | 过氧化氢俗称双氧水,是一种无色液体,容易分解,其分解产物是水和氧气.双氧水具有较强的消毒杀菌能力 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com