
科目: 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:选择题
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)  nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
温度/℃ | 1 | 2 | 4 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目: 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:填空题
(12分)
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:_________________________________
(2)碘也可用作心脏起搏器电源——锂碘电池的材料。该电池反应为2Li(s)+I2(s)===2LiI(s) ΔH
已知:①4Li(s)+O2(g)===2Li2O(s) ΔH1 ②4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2则电池反应的ΔH=__________
(3)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
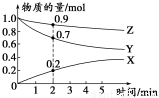
由此分析,该反应的化学方程式为___________________________________;从反应开始至2 min时,Z的反应速率为____________。
(4)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=10。在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为 ,若加水稀释至1000L,则溶液的pH为 。
查看答案和解析>>
科目: 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:填空题
(8分)一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,
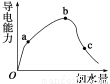
请回答:
(1)O点为什么不导电:_______________________________。
(2)a、b、c三点溶液的pH由小到大的顺序是______________。
(3)H+的物质的量最大的是________(填“a”、“b”或“c”)。
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的________(填序号)。
A.加热 B.加很稀的NaOH溶液
C.加NaOH固体 D.加水
E.加入锌粒
查看答案和解析>>
科目: 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:填空题
(10分)在一定温度下,将2 mol A和1 mol B两种气体相混合于体积为2 L的某密闭容器中(容积不变),发生如下反应:3A(g)+B(g)  xC(g)+2D(g)ΔH<0,2 min末反应达到平衡状态(温度不变),生成了1mol D,并测得C的浓度为0.5 mol·L-1,请填写下列空白:
xC(g)+2D(g)ΔH<0,2 min末反应达到平衡状态(温度不变),生成了1mol D,并测得C的浓度为0.5 mol·L-1,请填写下列空白:
(1)x的值等于________________。
(2)该反应的化学平衡常数K=________,升高温度时K值将________(选填“增大”、“减小”或“不变”)。
(3)A物质的转化率为__________________。
(4)若维持温度不变,在原平衡混合物的容器中再充入2mol C和2mol D,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充入A的物质的量为________ mol。
查看答案和解析>>
科目: 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:实验题
(10分)利用下图装置测定中和热的实验步骤如下:
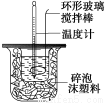
①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):____________________________________________________________________。
(2)倒入NaOH溶液的正确操作是__________(从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________(从下列选项中选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
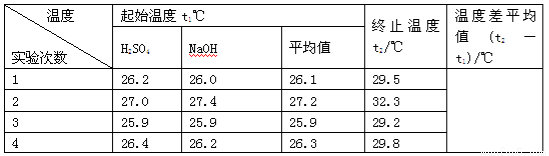
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
查看答案和解析>>
科目: 来源:2014-2015湖南省高二上学期期中化学试卷(解析版) 题型:填空题
(12分)某化学课外小组为测定空气中CO2的含量,进行了如下实验:
(1)配制0.100 0 mol·L-1和0.010 00 mol·L-1的标准盐酸。
(2)用0.100 0 mol·L-1的标准盐酸滴定未知浓度的Ba(OH)2溶液10.00 mL,结果用去盐酸19.60 mL。
(3)用测定的Ba(OH)2溶液吸收定量空气的CO2。取Ba(OH)2溶液10.00 mL,放入100 mL容量瓶里,加水至刻度线。取出稀释后的溶液放入密闭容器内,并通入10 L标准状况下的空气,振荡,这时生成沉淀。
(4)过滤上述所得浊液。
(5)取滤液20.00 mL,用0.010 00 mol·L-1的盐酸滴定,用去盐酸34.80 mL。请回答下列问题:
①配制标准盐酸时,需用下列哪些仪器________;
A.托盘天平
B.容量瓶
C.酸式滴定管
D.量筒
E.烧杯
F.胶头滴管
G.玻璃棒
②滴定操作中,左手__________,右手__________,眼睛________________________。
③Ba(OH)2溶液的物质的量浓度是________________________________________;
④过滤所得浊液的目的是_________________________________________________;
⑤此空气样品中含CO2的体积分数为______________________________________。
查看答案和解析>>
科目: 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:选择题
某食品袋中有一个写着“干燥剂”的小纸袋,里面的主要成分是生石灰,对此“干燥剂”的
说法正确的是
A.小纸袋中的物质可长期持续地做干燥剂
B.生石灰属于盐类
C.此干燥剂为混合物
D.其中钙元素的存在形态为游离态
查看答案和解析>>
科目: 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:选择题
下列有关分散系说法错误的是
A.胶体区别于其它分散系的本质特征是胶体粒子的直径大小在10-9~10-7m之间
B.Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
C.用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同
D.用肉眼观察,均匀透明的分散系一定是溶液
查看答案和解析>>
科目: 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:选择题
下列反应既是化合反应,又是氧化还原反应的是
A.NaOH + HCl == NaCl + H2O
B.2CO + O2点燃2CO2
C.H2 + CuO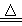 Cu + H2O
Cu + H2O
D.CaO + H2O == Ca(OH)2
查看答案和解析>>
科目: 来源:2014-2015福建省高一上学期期中化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.1mol任何气体的体积一定是22.4L
B.标准状况下,1mol N2和CO混合气体所占的体积约为22.4L
C.在标准状况下,体积为22.4L的物质都是1mol
D.在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com