
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.煤的干馏和石油的分馏均属化学变化
B.酯类和糖类均能发生水解反应
C. 生活中常见的石英玻璃、陶瓷都属于硅酸盐产品
D. 合金材料都是导体,可能含有非金属元素
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.1 mol Na2O2中含有的阴离子数为0.2NA
B.标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA
C.常温常压下,8gO3含有4 NA个电子
D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
Y | 最外层电子数是次外层的3倍 |
Z | 短周期中,其原子半径最大 |
Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
下列有关说法中正确的是( )
A.原子半径:X > Y > M
B. 由X、M和氢三种元素不可能形成离子化合物
C.气态氢化物热稳定性:M > Y > X
D.Z、Q、M的最高价氧化物对应的水化物可以两两发生反应
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ均正确且有因果关系的是:( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | 动物油脂相对不容易被氧化 | 油脂工业通常要将液态油脂氢化 |
B | HNO3具有酸的通性 | 硝酸常用作金属铜加工前的酸洗 |
C | 明矾可以净水 | 浑浊的石灰水加入明矾会变澄清 |
D | Si是一种非金属单质 | 单质Si能与NaOH溶液反应 |
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
常温下,对于下列电解质溶液,说法正确的是( )
A.pH=1的溶液中,Fe3+、I-、NO3-、K+可以大量共存
B.在c(SO )=0.1 mol·L-1的溶液中,Na+、Cl-、H+、Ca2+可以大量共存
)=0.1 mol·L-1的溶液中,Na+、Cl-、H+、Ca2+可以大量共存
C.工业上用过量的NaOH溶液吸收SO2:SO2 + OH- == HSO3-
D.将AlCl3溶液滴入NaOH溶液中反应的离子方程式:Al3+ + 4OH- = AlO2- + 2H2O
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是( )
A.I和II中H2O的电离程度不相等
B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH﹣)均减小
C.I和II溶液混合,若c(OH﹣)>c(H+),则氢氧化钠一定过量
D.I和II等体积混合后,溶液中离子浓度大小为c(CH3COO﹣)+ c(CH3COOH>c(Na+)
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.铜和铁与FeCl3溶液构成的原电池中:Cu +2 Fe3+ = Cu2+ + 2Fe2+
B.铁上镀锌时阴极析出6.5g锌,溶液中减少Zn2+数为0.1mol
C.在反应:4CuS + 5O2 = 2Cu2O + 4SO2中CuS既是氧化剂又是还原剂
D.生铁与浓H2SO4加热反应可产生SO2和CO2气体
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:选择题
下列实验操作不能达到预期实验目的的是( )
| 实验目的 | 实验操作 |
A | 鉴别CO32-和 SO42- | 分别加入饱和CaCl2溶液 |
B | 比较Al和Fe的金属活动性 | 分别加入浓NaOH溶液 |
C | 比较苯酚和乙酸的酸性 | 分别加入NaHCO3溶液 |
D | 比较AgCl和AgI的溶解度 | 向AgCl的饱和液中加少量KI溶液 |
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:简答题
.(本题16分)已知醛或酮可以发生如下反应:

苯丙氨酸(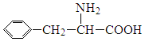 )是合成APM的原料之一。APM的结构简式如图所示。
)是合成APM的原料之一。APM的结构简式如图所示。

(1)指出APM的结构中含氧官能团的名称__________
(2)下列关于APM的说法中,正确的是 _。
A属于糖类化合物 B分子式为C14H18N2O5
C既能与酸反应,又能与碱反应
D能发生酯化反应,但不能发生加成反应
E1 molAPM与NaOH反应最终生成1mol H2O
(3)APM在酸性环境水解的产物中,相对分子质量为133的有机物与氨基乙酸(H2N-CH2COOH)以1:1发生缩合反应形成一个含有六元环的化合物。该环状化合物的结构简式为 。
(4)苯丙氨酸的一种合成途径如下图所示:

①烃 A的结构简式为 。1 molD完全燃烧消耗O2_______mol.
② 写出C → D反应的化学方程式: .
③ 某苯的同系物苯环上的一硝基取代物只有一种,该硝基取代物W是苯丙氨酸的同分异构体。W的结构简式为 。
查看答案和解析>>
科目: 来源:2013-2014广东省深圳市高三六校4月联考理综化学试卷(解析版) 题型:填空题
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图。回答有关问题:

①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________。
②从30分钟到35分钟达到新的平衡,改变的条件可能是 。
A. 增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为: 。
②电解池中产生CH4一极的电极反应式为: 。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。

下列叙述正确的是 。
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com