
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
能在透明溶液中大量共存的一组离子是
A.Na+、Al3+、Cl-、CO32- B.H+、Na+、Fe2+、MnO4-
C.K+、Cu2+、Cl-、NO3- D.K+、NH4+、OH-、SO42-
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
设nA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温常压下,8gO2含有2nA个电子
B.1L0.1mol·L-1的氨水中有nA个NH4+
C.标准状况下,22.4L盐酸含有nA个HCl分子
D.1molNa与足量氧气反应生成Na2O和Na2O2的混合物,失去nA个电子
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是
选项 | 叙述Ⅰ | 叙述Ⅱ |
A | NH4Cl为强酸弱碱盐 | 用加热法除去NaCl中的NH4Cl |
B | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
C | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
D | SiO2可与HF反应 | 氢氟酸不能保存在玻璃中 |
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
下列措施不合理的是
A.用SO2漂白纸浆和草帽辫
B.用硫酸清洗锅炉中的水垢
C.高温下用焦炭还原SiO2制取粗硅
D.用Na2S作沉淀剂,除去废水中的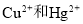
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.pH=4的醋酸中:c(H+)=4.0mol·L-1
B.饱和小苏打溶液中:c(Na+)= c(HCO3-)
C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-)
D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
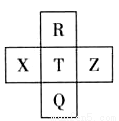
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:选择题
下列实验的现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
C | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:填空题
(16分)邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一:
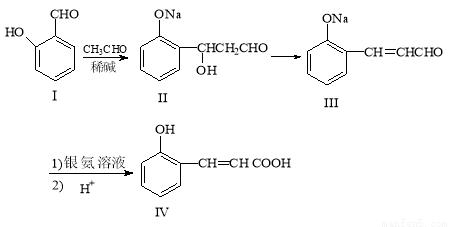
试回答下列问题:
(1)化合物Ⅰ的名称是 ;化合物II→化合物III 的有机反应类型: ;
(2)化合物III 在银氨溶液中发生反应化学方程式: ;
(3)有机物 X 为化合物IV的同分异构体,且知有机物X 有如下特点:
①苯环上的氢有两种,②能与NaHCO3 反应放出气体,③能发生银镜反应。
请写出两种化合物X的结构简式_____________________、___________________________
(4)下列说法正确的是 ;
A.化合物I遇氯化铁溶液呈紫色
B.化合物II能与NaHCO3溶液反应
C.1mol化合物IV完全燃烧消耗 9.5molO2
D.1mol化合物III最多能与3 molH2 反应
(5)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则 R 在NaOH 醇溶液中反应的化学方程式为 。
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:填空题
(16分)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g) CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1
①已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
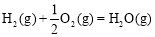 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为 ;
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:

ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g)  CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| 0min | 5min | 10min |
CO | 0.1 |
| 0.05 |
H2 | 0.2 |
| 0.2 |
CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 。
查看答案和解析>>
科目: 来源:2013-2014广东省高三5月第三次模拟理综化学试卷(解析版) 题型:填空题
(16分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg?L-1) | 成分 | 含量/(mg?L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42 | 2560 | Br- | 64 |
Mg2+ | 1272 |
|
|
电渗析法淡化海水示意图如图所示,其中阴(阳)
离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,
生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下: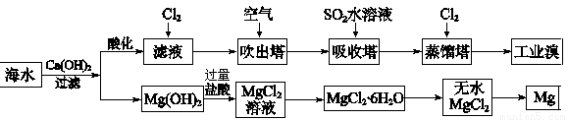
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离子方程式是 。解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
L(忽略Cl2溶解,溴的相对原子质量:80)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com