
科目: 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
己知: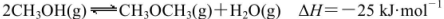 。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是
。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是

A.此时刻反应达到平衡状态
B.容器内压强不变时,说明反应达平衡状态
C.平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D.平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目: 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
结合如图装置判断,下列叙述正确的是
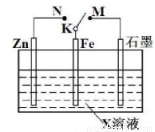
A.若X为NaCI,K与M相连时,石墨电极反应为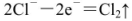
B.若X为硫酸,K与M相连时,Fe作负极受到保护
C.若X为硫酸,K与N相连时,溶液中H+向Fe电极移动
D.若X为NaCI,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成
查看答案和解析>>
科目: 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(17分)H2O2是一种强氧化剂,被广泛应用于水处理及卫生消毒等方面。
(1)H2O2不稳定,当其中含Fe2+时,会发生反应:
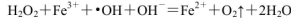 ,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
,则Fe2+在此过程中所起的作用是______________,当生成336mL O2(标准状况)时,反应中转移电子的物质的量为_______mol。
(2)下表是在常压、60℃和不同pH条件下,6mL30% H2O2在60min内释放出氧气的体积。则下列说法正确的是___________。
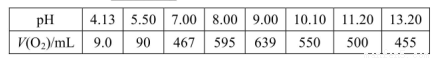
a.pH越大,H2O2的分解速率越大
b.pH在9左右,H2O2的分解速率最大
c.6mL 30% H2O2分解最多释放出的氧气的体积为639mL
d. pH=5.50时,0~60min内,v(O2)=1.5mL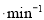
(3)溶液中H2O2的残留量可用一定浓度的酸性KMnO4溶液来测定,反应中MnO4-
被还原为Mn2+,该反应的离子方程式为______________。
(4)科学工作者以Ir-Ru/Ti为阳极、ACFC为阴极,在酸性环境、不断通入空气的条件下直接电解水来制备H2O2。电解过程中,阳极区溶液的pH_ (填“增大”“不变”或“减小”),阴极产生H2O2的电极反应式为_______。若不通空气,则阴极得到的产物是_______ 。
(5)己知断裂1mol化学键所需的能量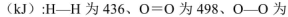
143,H-O为463。则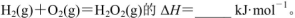 .
.
查看答案和解析>>
科目: 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(18分)运用化学反应原理研究氮、氯等单质及其化合物的反应有重要意义。
(1)科学家研究在一定条件下通过下列反应制备NH3:
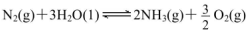
①在其他条件相同时,反应中NH3的体积分数(a)在不同温度下随反应时间(t)的变化如图。该反应的平衡常数表达式K=______,该反应中的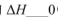 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
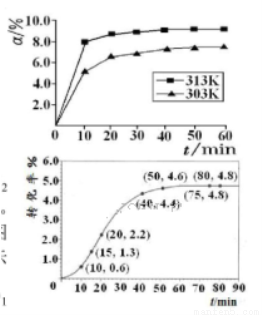
②某温度下,在2L容积不变的密闭容器中加入1molN2和6molH2O(1)发生反应,N2转化率随时间(t)变化如图。15-20min内,v(NH3)=____。若其他条件不变,在图中画出使用催化剂后N2的转化率随反应时间变化的曲线示意图。
(2) 25℃时,某同学将0.lmol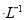 盐酸与0.2 mol
盐酸与0.2 mol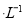 氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中
氨水等体积混合,所得混合溶液pH______7(填“>”“<”或“=”,下同),混合溶液中 (25℃时,NH3.H2O的电离常数
(25℃时,NH3.H2O的电离常数 )
)
(3) 25℃时,向O.lmol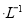 的MgCl2溶液中逐滴加入适量0.lmol
的MgCl2溶液中逐滴加入适量0.lmol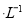 氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol
氨水,有白色沉淀生成,向反应后的浊液中,继续加入O.lmol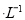 的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,
的FeCl3溶液,观察到的现象是______ ;上述过程中发生的所有反应的离子方程式为______。(25℃时,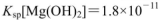 ,
,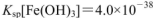 )
)
查看答案和解析>>
科目: 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:实验题
(18分)工业上从电解精炼铜的阳极泥(含金、银、铜、硒等单质)中提取硒的湿法工艺流程如下:
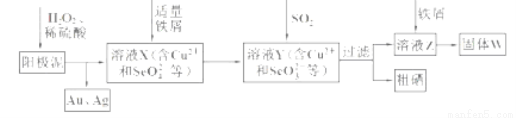
(1)向溶液X中加入铁屑的作用是______ ,此操作中不能加入过量铁粉的原因是______。
(2)检验溶液Z中阴离子的操作方法是______。
(3)过滤操作中要用到玻璃棒,请另举两例用到玻璃棒的实验或操作:______。
(4)实验室中制取SO2的原理为: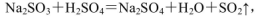 ,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
,此处应使用______(填“较浓的硫酸”或“稀硫酸”),原因是 ______。制取SO2的装置,最好选用下图中的______。
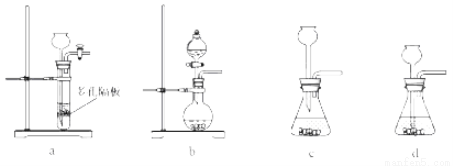
(5)粗硒中硒的含量可用如下方法测定: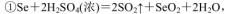
 通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol
通过用Na2S2O3标准溶液(显碱性)滴定反应②中生成的I2来计算硒的含量。滴定操作中用到的玻璃仪器有_______。实验中准确称量0.1200g粗硒样品,滴定中消耗0.2000mol 的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
的Na2S2O3溶液27.60mL,则粗硒样品中硒的质量分数为 。
查看答案和解析>>
科目: 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(12分)【化学——化学与技术】
合成氨工业对国民经济和社会发展具有重要意义,下图是工业合成氨的简要流程示意图。
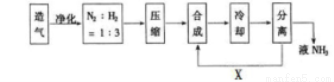
(1)合成氨的原料气往往混有CO2等杂质,在进入合成塔之前需净化,其原因是_______ 。
(2)工业上合成氨选择的适宜条件是:以铁为主的催化剂、_______、________。
(3)沿X路线进入合成塔的物质是_______,这样设计的意义是________。
(4)目前工业制硝酸所采用的主要方法是_______法。
查看答案和解析>>
科目: 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
(12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
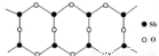
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。
查看答案和解析>>
科目: 来源:2013-2014山东省淄博市高三第三次模拟考试理综化学试卷(解析版) 题型:推断题
(12分)【化学——有机化学基础】
化合物F是合成新农药的重要中间体。

以化合物A(分子式为C7H7Cl)为原料合成化合物F的工艺流程如下:
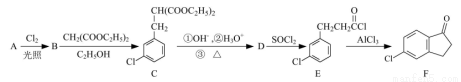
(1)反应A→B的化学方程式为_______。
(2)D的分子式为_______。
(3)化合物F中含氧官能团的名称为_________,B→C的反应类型为_______。
(4) E→F的转化中,会生成一种含有五元环的副产物且与F互为同分异构体,其结构简式为_______ 。
(5)反应C→D过程中,D可能发生水解,可用于检验的试剂是 _______。
查看答案和解析>>
科目: 来源:2013-2014山东省潍坊市下学期期中考试高一化学试卷(解析版) 题型:选择题
月球土壤中吸附着数百万吨的 He,每百吨
He,每百吨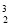 He核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于
He核聚变所释放出的能量相当于目前人类一年消耗的能量。下列关于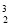 He的说法正确的是
He的说法正确的是
A.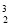 He原子核内含有2个中子 B.
He原子核内含有2个中子 B.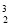 He原子核内含有3个质子
He原子核内含有3个质子
C.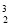 He原子核外有3个电子 D.
He原子核外有3个电子 D.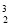 He和
He和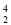 He是两种不同的核素
He是两种不同的核素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com